
题目列表(包括答案和解析)
硫酸钠-过氧化氢-氯化钠加合物(xNaSO4·yH2O2·zNaCl)又称固体双氧水,是一种新型精细化工产品,具有漂白、杀菌、消毒等作用。为探究该加合物的组成,某化学兴趣小组设计并进行了如下实验:
第一步:准确称取6.945g样品,配制成250.00ml无色溶液A
第二步:准确量取25.00ml溶液A于锥形瓶中,加适量稀硫酸酸化后,用0.0400mol/LKMnO4标准溶液滴定至终点,消耗溶液KMnO420.00ml
第三步:另取25.00ml溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.932g.
请回答下列问题:
(1)欲配制无色溶液A,所需要的仪器除药匙、分析天平、玻璃棒、胶头滴管外,还应有 。
(2)配平下列离子方程式______MnO4-+_____H2O2+_________=______Mn2++_____O2↑+______。
(3)滴定前,KMnO4标准溶液应盛装于中 (填仪器名称),滴定终点现象为 。
(4)第三步能否通过加入AgNO3溶液的方法来测定?为什么
(5)滴定前,滴定管用蒸馏水洗净后,未用KMnO4标准溶液润洗,则Y值______________(填“偏
高 偏低 无影响”)
(6)通过计算确定样品的组成为 。
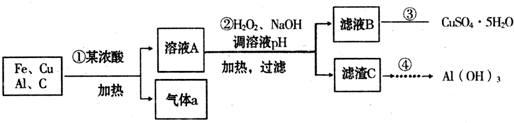
(12分)2008年9月25日我国“神七”成功发射,标志着我国载人航天技术迈出重要的一步。“神七”以N2H4和N2O4燃料,N2H4学名为肼又称联氨,无色油状液体,具有与氨相似的气味,毒性很大。
⑴水电离成H3O+和OH-叫做水的自偶电离。同水一样,N2H4也有微弱的自偶电离,其自偶电离的方程式为: 。
⑵氨显碱性的原因在于NH3分子中的N原子具有孤对电子,它能通过配位键结合水中的H+,使水电离出OH-,其过程可以表示为NH3+H2O![]() NH4++OH-。试问N2H4与足量盐酸反应的化学方程式: 。
NH4++OH-。试问N2H4与足量盐酸反应的化学方程式: 。
⑶已知硼酸[B(OH)3]为一元弱酸,其显示酸性的原理与NH3、N2H4显示碱性的原理类似,试用离子方程式表示其显示酸性的过程: 。
⑷N2H4和N2O4反应温度达2700摄氏度,产生无污染的气体。1g 液态N2H4与足量的液态N2O4充分反应生成两种气态物质,可放出a KJ热量,试写出该反应的热化学方程式:
。
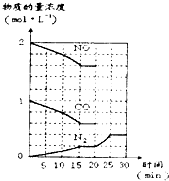
 CO2、SO2、NOx是重要的非金属氧化物,与我们的生存环境息息相关.
CO2、SO2、NOx是重要的非金属氧化物,与我们的生存环境息息相关.湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com