
题目列表(包括答案和解析)
(1)向海水中加入氯水使NaBr氧化,反应为_____________________________。
(2)向所得溶液中鼓入空气,将溴吹出用纯碱吸收生成NaBr、NaBrO3和CO2,反应方程式为_____________________________________。
(3)将(2)所得溶液用硫酸酸化,使NaBr、NaBrO3转化成单质溴,反应式为___________________________。
(4)这种制得的溴含少量Cl2,除去Cl2的方法是__________________。
(1)向海水中通入Cl2,将海水中的溴化物氧化,其离子方程式为:__________________.
(2)向上述混合液中吹入热空气,将生成的溴吹出并用纯碱溶液吸收使其生成NaBr、NaBrO3,其化学方程式为____________.
(3)将(2)所得溶液用H2SO4酸化,使NaBr、NaBrO3中的溴转化为单质溴,再用有机溶剂提取溴后还可得到副产品Na2SO4,写出这一过程的化学方程式____________.
(4)这样得到的溴中还混有少量Cl2,怎样除去?
工业上从海水中提取溴采用下列方法:
(1)向海水中加入氯水使NaBr氧化,反应的化学方程式为:
____________________________________________________________.
(2)向所得溶液中鼓入空气,将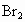 吹出,用纯碱吸收,生成NaBr、
吹出,用纯碱吸收,生成NaBr、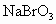 ,反应的化学方程式为:
,反应的化学方程式为:
____________________________________________________________.
(3)将(2)所得溶液用硫酸酸化,使NaBr、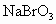 转化成单质溴,反应的化学方程式为:
转化成单质溴,反应的化学方程式为:
____________________________________________________________.
工业上从海水中提取溴采用下列方法:
(1)向海水中加入氯水使NaBr氧化,反应的化学方程式为:
____________________________________________________________.
(2)向所得溶液中鼓入空气,将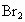 吹出,用纯碱吸收,生成NaBr、
吹出,用纯碱吸收,生成NaBr、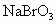 ,反应的化学方程式为:
,反应的化学方程式为:
____________________________________________________________.
(3)将(2)所得溶液用硫酸酸化,使NaBr、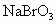 转化成单质溴,反应的化学方程式为:
转化成单质溴,反应的化学方程式为:
____________________________________________________________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com