
题目列表(包括答案和解析)
| 高温高压 |
| 催化剂 |
(12)氨是重要的无机化工原料,也是合成氮肥的主要原料,因此合成氨在国民经济中占有重要地位。
⑴工业合成氨反应的化学方程式为 。
⑵恒温下,向一个2L的密闭容器中充入1mol N2和2.6mol H2,20min时,反应达到平衡,容器内c(NH3)为0.08 ,则c(H2)=
,20min内,用N2浓度的变化表示的反应速率为
。
,则c(H2)=
,20min内,用N2浓度的变化表示的反应速率为
。
⑶某温度下,向一个2L的密闭容器中充入1mol N2和3mol H2,在恒温下反应,以下能说明反应达到平衡状态的是
①单位时间内消耗0.1molN2的同时生成0.2molNH3
②单位时间内生成0.3molH2的同时生成0.2molNH3
③n(N2)∶n(H2)∶n(NH3)=1∶3∶2
④c(NH3)=0.08mol/L
⑤容器内压强不变
⑷工业上约有80%的氨用于制造化肥。某化肥厂生产铵态氮肥(NH4)2SO4的反应可表示为:CaSO4+2NH3+CO2+H2O= CaCO3+(NH4)2SO4
①反应前先将CaSO4磨成粉末,加入水中制成悬浊液,则所得分散系中分散质粒子直径 10-7m(填“>”或“<”)。
②向CaSO4悬浊液中通入气体时,需先通入足量NH3再通入CO2,原因是 。
(12)氨是重要的无机化工原料,也是合成氮肥的主要原料,因此合成氨在国民经济中占有重要地位。
⑴工业合成氨反应的化学方程式为 。
⑵恒温下,向一个2L的密闭容器中充入1mol N2和2.6mol H2,20min时,反应达到平衡,容器内c(NH3)为0.08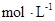 ,则c(H2)= ,20min内,用N2浓度的变化表示的反应速率为 。
,则c(H2)= ,20min内,用N2浓度的变化表示的反应速率为 。
⑶某温度下,向一个2L的密闭容器中充入1mol N2和3mol H2,在恒温下反应,以下能说明反应达到平衡状态的是
①单位时间内消耗0.1molN2的同时生成0.2molNH3
②单位时间内生成0.3molH2的同时生成0.2molNH3
③n(N2)∶n(H2)∶n(NH3)=1∶3∶2
④c(NH3)=0.08mol/L
⑤容器内压强不变
⑷工业上约有80%的氨用于制造化肥。某化肥厂生产铵态氮肥(NH4)2SO4的反应可表示为:CaSO4+2NH3+CO2+H2O=CaCO3+(NH4)2SO4
①反应前先将CaSO4磨成粉末,加入水中制成悬浊液,则所得分散系中分散质粒子直径 10-7m(填“>”或“<”)。
②向CaSO4悬浊液中通入气体时,需先通入足量NH3再通入CO2,原因是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com