
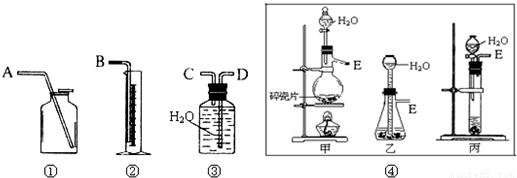
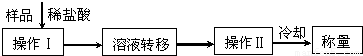
题目列表(包括答案和解析)

| 读数次数 | 质量/g | |
锥形瓶十水十试样 |
第1次 | 196.4 |
| 第2次 | 196.2 | |
| 第3次 | 196.1 | |
| 第4次 | 196.0 | |
| 第5次 | 196.0 |

已知Cl-和Ag+反应生成AgCl,每次新生成的AgCl中又有10%见光分解成单质银和氯气,氯气又可在水溶液中岐化成HClO3(为强酸)和HCl。而这样生成的Cl-又与剩余的Ag+作用生成沉淀,如此循环往复,直至最终。现有含1.1molNaCl的溶液,向其中加入足量AgNO3,求最终能生成多少克难溶物(AgCl和Ag)?若最后溶液体积为1L,求溶液中H+物质的量浓度是多少?
| 读数次数 | 质量/g | |
锥形瓶十水十试样 | 第1次 | 196.4 |
| 第2次 | 196.2 | |
| 第3次 | 196.1 | |
| 第4次 | 196.0 | |
| 第5次 | 196.0 |
 已知溶液中:还原性HSO3->I-,氧化性:IO3->I2>SO42-.在含3mol NaHSO3的溶逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系如图所示,则下列说法错误的是( )
已知溶液中:还原性HSO3->I-,氧化性:IO3->I2>SO42-.在含3mol NaHSO3的溶逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系如图所示,则下列说法错误的是( )湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com