
题目列表(包括答案和解析)
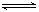 7N2+12H2O可处理NO2。当转移3.6mol电子时,生成的N2在标准状况下是 L。
7N2+12H2O可处理NO2。当转移3.6mol电子时,生成的N2在标准状况下是 L。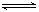 2SO3(g) ΔH =" —196.6" kJ·mol-1
2SO3(g) ΔH =" —196.6" kJ·mol-1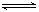 SO3(g)+NO(g) ΔH = —41.8kJ·mol-1
SO3(g)+NO(g) ΔH = —41.8kJ·mol-1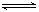 2NO2(g)的 ΔH =" _________" kJ·mol-1
2NO2(g)的 ΔH =" _________" kJ·mol-1 CH3OH(g),达平衡后测得各组分浓度如下:
CH3OH(g),达平衡后测得各组分浓度如下:| 物质 | CO | H2 | CH3OH |
| 浓度(mol?L—1) | 0.9 | 1.0 | 0.6 |
(14分) 研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)利用反应6NO2+8NH3  7N2+12H2O可处理NO2。当转移3.6mol电子时,生成的N2在标准状况下是
L。
7N2+12H2O可处理NO2。当转移3.6mol电子时,生成的N2在标准状况下是
L。
(2)已知:反应1:2SO2(g)+O2(g) 2SO3(g) ΔH = —196.6 kJ·mol-1
2SO3(g) ΔH = —196.6 kJ·mol-1
反应2:NO2(g)+SO2(g) SO3(g)+NO(g) ΔH = —41.8kJ·mol-1
SO3(g)+NO(g) ΔH = —41.8kJ·mol-1
则反3:2NO(g)+O2(g) 2NO2(g)的 ΔH
= _________ kJ·mol-1
2NO2(g)的 ΔH
= _________ kJ·mol-1
(3) 一定条件下,将2molNO与2molO2置于恒容密闭容器中发生上述反应3,下列各项能说明反应达到平衡状态的是 。
a.体系压强保持不变 b.混合气体颜色保持不变
c.NO和O2的物质的量之比保持不变 d.每消耗1 molO2同时生成2 molNO2
(4)CO可用于合成甲醇,一定温度下,向体积为2L的密闭容器中加入CO和H2,发生反应CO(g)+2H2(g) CH3OH(g),达平衡后测得各组分浓度如下:
CH3OH(g),达平衡后测得各组分浓度如下:
|
物质 |
CO |
H2 |
CH3OH |
|
浓度(mol•L—1) |
0.9 |
1.0 |
0.6 |
①混合气体的平均相对分子质量__________________________。
②列式并计算平衡常数K=__________________________。
③若将容器体积压缩为1L,不经计算,预测新平衡中c(H2)的取值范围是__________。
④若保持体积不变,再充入0.6molCO和0.4molCH3OH,此时v正___v逆(填“>”、“<”或“=”)。
| 物质 | CO | H2 | CH3OH |
| 浓度(mol?L-1) | 0.9 | 1.0 | 0.6 |

 。
。 0(填“>”“<”或“=”)。
0(填“>”“<”或“=”)。| A.升高温度 | B.充入氮气 | C.将水蒸气从体系中分离 | D.用更有效的催化剂 |
 2SO3(g) ΔH=" —196.6" kJ·mol―1
2SO3(g) ΔH=" —196.6" kJ·mol―1 2NO2(g) ΔH= —113.0 kJ·mol―1
2NO2(g) ΔH= —113.0 kJ·mol―1 SO3(g) + NO(g) 的ΔH= 。
SO3(g) + NO(g) 的ΔH= 。(7分)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
(1)T在周期表中的位置 __________,第六周期与R同主族元素的原子序数为 ,该元素为 元素(填“金属”或“非金属”)
(2)元素的非金属性(原子得电子的能力):Q________T(填“强于”或“弱于”)。
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为______________________________________________。
(4)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2 L的甲气体与0.5 L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的 R的含氧酸盐只有一种,则该含氧酸盐的化学式是____________。
【解析】根据元素在周期表中的位置可知T属于第三周期,T所处的周期序数与主族序数相等,所以T是Al,则Q是C,R是N,W是S。
(1)N是第ⅤA,所以第六周期、第ⅤA元素的原子序数是7+8+18+18+32=83,该元素是铅,属于金属元素。
(2)C是非金属,Al是金属,前者的非金属性强于后者。
(3)单质硫的化合价是0价,浓硫酸中硫的化合价是+6价,若二者反应的生成物只有2种,且一种是气体,因为生成物一定有水,则该气体只能是SO2。
(4)N的氧化物中相对分子质量最下的是NO。在反应中NO和O2的物质的量之比是4︰1,根据得失电子守恒可知NO的失去1个电子,化合价由+2价升高到+3价,因此含氧酸盐是NaNO2。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com