
题目列表(包括答案和解析)
某研究性学习小组为证明在同温同压下,相同浓度、相同体积酸性不同的两种二元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图所示.该实验的主要操作步骤如下:
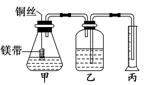
Ⅰ.①配制浓度均为0.5 mol/L 的H2SO4和H2C2O4溶液。
②用 量取10.00 mL 0.5 mol/L H2SO4和H2C2O4溶液分别于两个锥形瓶中.
③分别称取除去表面氧化膜的镁带并系于铜丝末端。
④检查装置的气密性,在广口瓶中装满水,按图连接好装置。
⑤将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触)至反应完全后,记录 。
⑥反应结束后,读取量筒内水的体积为 y mL。
Ⅱ.请将上述步骤补充完整并回答下列问题:
(1)用密度为1.84 g/cm3 98%的浓H2SO4,配制浓度为250 mL 0.5 mol/L的H2SO4溶液,所需要的主要仪器有 、 、烧杯、玻璃棒、酸式滴定管。
(2)以下是读取量筒内水的体积时,必须包括的几个步骤:①使乙、丙中液面相平;②将装置冷却至室温;③读取量筒内水的体积.这三步操作的正确顺序是 。
(3)读取量筒内水的体积时,若丙中液面高于乙中液面,使乙、丙中液面相平的操作是 。
(4)简述速率不等的原因 ,
铜丝不与酸接触的原因 。
(8分)某研究性学习小组为证明在同温同压下,相同浓度、相同体积酸性不同的两种二元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图所示.该实验的主要操作步骤如下:

Ⅰ.①配制浓度均为0.5 mol/L 的H2SO4和H2C2O4溶液。
②用 量取10.00 mL 0.5 mol/L H2SO4和H2C2O4溶液分别于两个锥形瓶中.
③分别称取除去表面氧化膜的镁带并系于铜丝末端。
④检查装置的气密性,在广口瓶中装满水,按图连接好装置。
⑤将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触)至反应完全后,记录 。
⑥反应结束后,读取量筒内水的体积为 y mL。
Ⅱ.请将上述步骤补充完整并回答下列问题:
(1)用密度为1.84 g/cm3 98%的浓H2SO4,配制浓度为250 mL 0.5 mol/L的H2SO4溶液,所需要的主要仪器有 、 、烧杯、玻璃棒、酸式滴定管。
(2)以下是读取量筒内水的体积时,必须包括的几个步骤:①使乙、丙中液面相平;②将装置冷却至室温;③读取量筒内水的体积.这三步操作的正确顺序是 。
(3)读取量筒内水的体积时,若丙中液面高于乙中液面,使乙、丙中液面相平的操作是 。
(4)简述速率不等的原因 ,
铜丝不与酸接触的原因 。
有下列药品:⑩NaOH(固体) ![]() 标准NaOH溶液
标准NaOH溶液 ![]() 未知浓度的盐酸
未知浓度的盐酸 ![]() Na2CO3溶液
Na2CO3溶液
试回答以下问题:
(1)做酸碱中和滴定时,还缺少的试剂是 和 。
(2)下面是一段关于中和滴定实验操作的叙述:
A.取一锥形瓶,用待测液盐酸润洗两次,然后往润洗后的锥形瓶中加入25.00 mL待测液盐酸;
B.在待测液中加入几滴酚酞作指示剂;
C.取一支已洗净的酸式滴定管,注入标准NaOH溶液,进行滴定;
D.左手旋转滴定管的玻璃活塞,右手不停摇动锥形瓶;
E.两眼注视滴定管内NaOH液面下降,直至滴定终点。
文中所述操作有错误的序号为 。
(3)欲配制250 mL 0.1·L-1 Na2CO3溶液时,还缺少的仪器是 和 。
(4)过滤时,应选用上述仪器中的 (填序号)。
A.用托盘天平称量50.56 g氯化钾
B.用50 mL量筒量取5.0 mL稀H2SO4
C.用碱式滴定管量取18.5 mL 1 mol·L-1的NaOH溶液
D.用250 mL容量瓶配制200 mL 0.1 mol·L-1的Na2CO3溶液
E.欲在烧杯中加热配制50 mL某溶液,应选用的烧杯规格是250 mL
F.用50 mL酸式滴定管量取25 mL稀盐酸的操作是:将盐酸加入酸式滴定管使其凹液面正好与25 mL刻度相切,将溶液全部放入烧杯,可准确量取25 mL稀盐酸
G.用pH试纸检验溶液酸碱性的操作是:先取一块试纸放在表面皿或玻璃片上,用沾有待测液的玻璃棒点在试纸中部,观察颜色的改变并在半分钟内与标准比色卡对比,确定溶液的pH
(2)请选用下列试剂:酚酞、石蕊、稀氨水、氯化铵溶液、浓盐酸、熟石灰粉末、醋酸铵晶体和蒸馏水,设计实验证明NH3·H2O在水中存在电离平衡,请简述实验方法及现象。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com