
题目列表(包括答案和解析)
某课外兴趣小组对一批铁样品(含有杂质,杂质不溶于水,也不与稀硫酸反应)进行分析,甲、乙、丙三位同学分别进行实验,其中只有一位同学所取用的稀硫酸与铁样品恰好完全反应。实验数据如下表:
| 甲 | 乙 | 丙 | |
| 烧杯+稀硫酸 | 200 g | 150 g | 150 g |
| 加入的铁样品 | 9 g | 9 g | 14 g |
| 充分反应后,烧杯+剩余物 | 208.7 g | 158.7 g | 163.7 g |
请你认真分析数据,完成下列问题:
(1)哪位同学所取用的稀硫酸与铁样品恰好完全反应?
(2)计算样品中铁的质量分数。
(3)计算恰好完全反应后所得溶液中溶质的质量分数。
(烧杯的质量为25.4 g;计算结果精确到1%)
| 甲 | 乙 | 丙 |
烧杯+稀硫酸 | 200 g | 150 g | 150 g |
加入的铁样品 | 9 g | 9 g | 14 g |
充分反应后,烧杯+剩余物 | 208.7 g | 158.7 g | 163.7 g |
请你认真分析数据,完成下列问题:
(1)哪位同学所取用的稀硫酸与铁样品恰好完全反应?
(2)计算样品中铁的质量分数。
(3)计算恰好完全反应后所得溶液中溶质的质量分数。
(烧杯的质量为25.4 g;计算结果精确到1%)
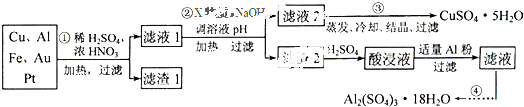
电子产品产生的大量电子垃圾对环境构成了极大的威胁。某化学兴趣小组将一批废弃的线路板简单处理后,得到含Cu、Al、Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:

按要求回答下列问题:
(1)滤渣1中存在的金属有_____________。
(2)已知沉淀物的pH如下表:
|
|
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
Fe2+ |
7.0 |
9.0 |
|
Fe3+ |
1.9 |
3.7 |
|
Cu2+ |
4.9 |
6.7 |
|
Al3+ |
3.0 |
4.4 |
①则操作②中X物质最好选用的是___________(填编号)
a.酸性高锰酸钾溶液 b.漂白粉 c.氯气 d.双氧水
②理论上应控制溶液pH的范围是________________________。
(3)检验滤液2中既不存在Fe2+又不存在Fe3+的操作步骤是____________________。
(4)用一个离子方程式表示在酸浸液中加入适量铝粉的反应:___________________。
(5)由CuSO4·5H2O制备CuSO4时,应把CuSO4·5H2O放在______(填仪器名称)中加热脱水。
(6)现在某些电器中使用的高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为 3Zn + 2K2FeO4 + 8H2O 3Zn(OH)2
+ 2Fe(OH)3 + 4KOH,该电池放电时负极反应式为_______,每有1mol K2FeO4被还原,转移电子的物质的量为____,充电时阳极反应式为___________。
3Zn(OH)2
+ 2Fe(OH)3 + 4KOH,该电池放电时负极反应式为_______,每有1mol K2FeO4被还原,转移电子的物质的量为____,充电时阳极反应式为___________。
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.7 |
| Cu2+ | 4.9 | 6.7 |
| Al3+ | 3.0 | 4.4 |
| c(Cu2+) |
| c(Ca2+) |
| Ksp(CuCO3) |
| Ksp(CaCO3) |
| c(Cu2+) |
| c(Ca2+) |
| Ksp(CuCO3) |
| Ksp(CaCO3) |
| ||
| ||
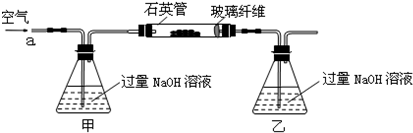
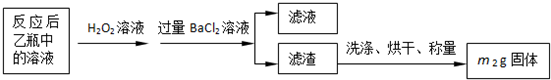
| 32m2 |
| 233m1 |
| 32m2 |
| 233m1 |
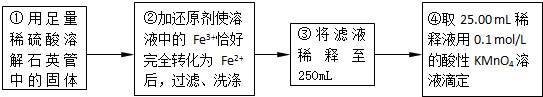
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗KMnO4溶液体积/mL | 25.00 | 25.03 | 24.97 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com