
题目列表(包括答案和解析)
按要求回答下列问题:
(1)实验室中常用NaOH溶液来进行洗气和提纯,当100mL 3mol/L的NaOH溶液吸收标准状况下4.48L CO2时,所得溶液中各离子浓度由大到小的顺序为
(2)常温下向一定体积的0.1 mol/L醋酸溶液中加水稀释后,下列说法正确的是 。
A.溶液中导电粒子的数目减少
B醋酸的电离程度增大,c(H+)亦增大
C.溶液中 不变
不变
D溶液中 减小
减小
(3)①常温下将0.15 mol/L稀硫酸V1 mL与0.1 mol/L NaOH溶液V2 mL混合,所得溶液的pH为1,则V1:V2= (溶液体积变化忽略不计)。
②常温下若溶液由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2mL混合而得,则下列说法正确的是
A.若反应后溶液呈中性,则
B.若V1=V2,反应后溶液pH一定等于7
C.若反应后溶液呈酸性,则V1一定大于V2
D.若反应后溶液呈碱性,则V1一定小于V2
(4)常温下,浓度均为0.lmol/L的下列五种溶液的PH值如表所示:

①根据表中数据,将浓度均为0.01 mol/L的下列四种酸的溶液分别稀释100倍,pH变化最小的是
A.HCN B.HClO C.H2CO3 D.CH3COOH
②根据以上数据,判断下列反应可以成立的是 。

(5)几种离子开始沉淀时的pH如下表:

当向含相同浓度 离子的溶液中滴加NaOH溶液时,
(填离子符号)先沉淀,
离子的溶液中滴加NaOH溶液时,
(填离子符号)先沉淀, (填“>”、“二”或“<”)。
(填“>”、“二”或“<”)。
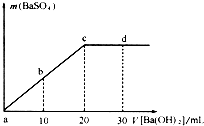 (2011?浦东新区一模)如图,常温下,向一定体积的0.1mol/L的硫酸溶液中逐滴加入浓度相同的Ba(OH)2溶液,生成沉淀的量与加入Ba(OH)2溶液的体积关系,a、b、c、d分别表示实验中不同阶段的溶液,下列有关说法中不正确的是( )
(2011?浦东新区一模)如图,常温下,向一定体积的0.1mol/L的硫酸溶液中逐滴加入浓度相同的Ba(OH)2溶液,生成沉淀的量与加入Ba(OH)2溶液的体积关系,a、b、c、d分别表示实验中不同阶段的溶液,下列有关说法中不正确的是( ) (12分) 有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子:(每种物质只含一种阳离子和一种阴离子且互不重复)
| 阳离子 | Na+、Ba2+、NH4+、K+ |
| 阴离子 | CH3COO-、Cl-、OH-、SO42- |
(6分)有A、B、C、D四种强电解质,它们在水中可电离出下列离子(每种物质只含一种阳离子和一种阴离子,且互不重复)。
|
阳离子 |
Na+、K+、Ba2+、NH4+ |
|
阴离子 |
SO42-、Cl-、OH-、CH3COO- |
已知:
①A、C溶液的pH均大于7,B溶液的pH小于7;D溶液焰色反应显黄色。
②C溶液与D溶液混合后生成白色沉淀;B溶液与C溶液混合后生成有刺激性气味的气体。
(1)B中阳离子是(填化学式) 。
(2)写出C溶液与D溶液反应的离子方程式: 。
⑶25℃时,pH=9的A溶液和pH=9的C溶液中水的电离程度小的是 (填A或C的化学式)。
⑷25℃时,用惰性电极电解 D 的水溶液,一段时间后溶液的pH_____7(填“>”、“<”或“=”)。
⑸将等体积等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序为 。
⑹25℃时,在一定体积0.2 mol · L—1的C溶液中,加入一定体积的0.1 mol · L-1的盐酸时,混合溶液的pH=13。若反应后溶液的体积等于C溶液与盐酸的体积之和,则C溶液与盐酸的体积比是_ _
(16分)草酸(H2C2O4)是一种二元弱酸,主要用作还原剂和漂白剂。草酸的盐可用作碱土金属离子的广谱沉淀剂。
(1)40 ℃时混合一定体积的0.1 mol/L H2C2O4溶液与一定体积0.01 mol/L酸性KMnO4溶液,填写表中空格。
| 温度 | v(H2C2O4) | v(KMnO4) | KMnO4褪色时间 |
| 40 ℃ | 10 ml | 10 ml | 40 s |
| 40 ℃ | 20 ml | 20 ml |
|
(2)用甲基橙作指示剂,通过酸碱滴定可测定草酸溶液浓度。甲基橙是一种常用的酸碱指示剂,甲基橙(用化学式HIn表示)本身就是一种有机弱酸,其电离方程式为:HInH++In—。则酸根离子In—的颜色是 。甲基橙的酸性与草酸相比, (填前者强、前者弱、十分接近、无法判断)。
(3)常温下有pH均为3的盐酸和草酸溶液各10 ml,加水稀释,在答题卷上画出稀释过程中两种溶液中c(H+)变化的示意图并作必要的标注。
(4)常温下MgC2O4的Ksp=8.1×10-5,已知当溶液中某离子的浓度≤10-5 mol/L时可认为该离子已沉淀完全。现为了沉淀1 L0.01 mol/LMgCl2溶液中的Mg2+,加入100 mL0.1 mol/L的(NH4)2C2O4溶液,通过计算判断Mg2+是否已沉淀完全。
(5)(NH4)2C2O4溶液因NH4+水解程度稍大于C2O42-而略显酸性,0.1 mol/L(NH4)2C2O4溶液pH值6.4。现有某未知溶液,常温下由水电离出的c(H+)=1.0×10-5 mol/L,该溶液pH可能是 (填字母)。
A.5 B.6 C.7 D.9
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com