
题目列表(包括答案和解析)
下列关于1 mol/L Na2SO4溶液的说法正确的是。
A.溶液中含有1 mol Na2SO4
B.1 mol Na2SO4溶于1 L蒸馏水中
C.将322 g Na 2SO4·10H2O溶于少量水后再稀释到1000 mL
D.将322 g Na 2SO4·10H2O溶于少量水后再稀释到500 mL
下列关于1 mol/L Na2SO4溶液的说法正确的是。
| A.溶液中含有1 mol Na2SO4 |
| B.1 mol Na2SO4溶于1 L蒸馏水中 |
| C.将322 g Na 2SO4·10H2O溶于少量水后再稀释到1000 mL |
| D.将322 g Na 2SO4·10H2O溶于少量水后再稀释到500 mL |
| A.溶液中含有1 mol Na2SO4 |
| B.1 mol Na2SO4溶于1 L蒸馏水中 |
| C.将322 g Na 2SO4·10H2O溶于少量水后再稀释到1000 mL |
| D.将322 g Na 2SO4·10H2O溶于少量水后再稀释到500 mL |
下表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp(25℃)。
|
电解质 |
电离方程式 |
电离常数K |
Ksp |
|
H2CO3 |
H2CO3 HCO3- |
K1=4.31×10-7 K2=5.61×10-11 |
- |
|
C6H5OH |
C6H5OH |
1.1×10-10 |
- |
|
H3PO4 |
H3PO4 H2PO4- HPO42- |
K1=7.52×10-3 K2=6.23×10-6 K1=2.20×10-13 |
- |
|
NH3·H2O |
NH3·H2O |
1.76×10-5 |
- |
|
BaSO4 |
BaSO4(s) |
- |
1.07×10-10 |
回答下列问题:
(1)写出C6H5OH与Na3PO4反应的离子方程式:_________________。
(2)25℃时,向10 mL 0. 01 mol/LC6H5OH溶液中滴加V mL 0.1 mol/L氨水,混合溶液中粒子浓度关系正确的是__________(填序号)。
a.若混合液pH>7,则V≥10
b.V=5时,2c(NH3·H2O)+2c(NH4+)=c(C6H5OH)+c(C6H5O-)
c.V=10时,混合液中水的电离程度小于0.01 mol C6H5OH溶液中水的电离程度
C6H5OH溶液中水的电离程度
d.若混合液pH<7,则c(NH4+)>c(C6H5O-)>c(H+)>c(OH-)
(3)水解反应的化学平衡常数称为水解常数(用Kb表示),类比化学平衡常数的定义。25℃时,Na2CO3第一步水解反应的水解常数Kb=____mol/L。
(4)如图所示,有T1、T2不同温度下两条BaSO4在水中的沉淀溶解平衡曲线(已知BaSO4的Ksp随温度升高而增大)。
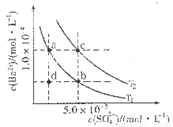
①T2____ 25℃(填“>”、“<”或“=”);
②讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法正确的是____(填序号)。
a.加入Na2SO4不能使溶液由a点变为b点
b.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
c.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
d.升温可使溶液由b点变为d点
(1)下列有关镍镉电池的说法中,正确的是___________(填标号)。??
A.其充电和放电过程的反应互为可逆反应?
B.放电时,化学能转化为电能?
C.充电时,电解质溶液的pH不变?
D.放电时,镉为负极?
(2)充电时,阴极上发生反应的电极反应式是______________________________________。
(3)废镍镉电池会污染土壤,在酸性土壤中污染尤为严重,其原因是__________________。
(4)以镍镉电池为电源电解Na2SO4水溶液,当收集到气体的总体积为33.6 L(标准状况)时,镍镉电池中转移了_________mol 电子。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com