
题目列表(包括答案和解析)
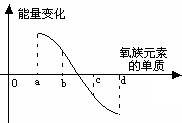
(9分)元素周期律是指导我们学习元素及其化合物知识的重要工具。已知氧族元素(不含Po)的部分知识如下表所示,
| 元素 | 8O | 16S | 34Se | 52Te |
| 单质熔点(℃) | -218.4 | 113 | | 450 |
| 单质沸点(℃) | -183 | 444.6 | 685 | 1390 |
| 元素主要化合价 | -2 | -2,+4,+6 | -2,+4,+6 | |
| 原子半径 | 逐渐增大 | |||
| 单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
有关元素X、Y、Z、D、E的信息如下:
| 元素 | 有关信息 |
| X | 元素主要化合价-2,原子半径为0.0074nm |
| Y | 所在主族序数与所在周期序数之差为4 |
| Z | 单质在X的单质中燃烧,产物是造成酸雨的罪魁祸首之一 |
| D | 最高价氧化物对应的水化物能电离出电子数相等的阴、阳离子 |
| E | 单质是生活中的常见金属,其制品在潮湿空气中易被腐蚀或损坏 |
请回答下列问题(用化学用语表示):
(1)X的一种氢化物可用于实验室制取X的单质,其反应的化学方程式为
。
(2)比较Y与Z的氢化物的稳定性 > (用化学式表示)。
(3)E元素与Y元素可形成EY2和EY3,两种化合物,则下列说法中正确的是 (填序号)
①通常实验室配制EY2溶液时,可直接用水溶解EY3固体
②EY2不能通过单质直接化合产生
③铜片、碳棒和EY3溶液组成原电池,电子由铜片沿导线流向碳棒
④Y、Z、D的离子半径大小依次减小
(4)Y的最高价氧化物为无色液体,当0.25mol该物质与一定量的水混合得到一种稀溶液时,放出![]() 的热量。写出该反应的热化学方程式 。
的热量。写出该反应的热化学方程式 。
(5)写出E在潮湿的空气中发生腐蚀时正极上的电极反应式 。
(6)氯碱工业上制取气体Y单质的反应时,当电路中通过![]() 电子时,阴阳两极共产生气体 L(标准状况)。
电子时,阴阳两极共产生气体 L(标准状况)。
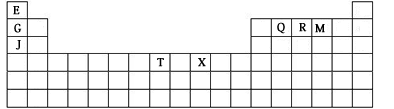
(10分)下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。
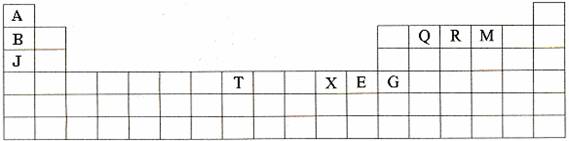
(1)T3+的核外电子排布式是: 。
(2)Q、R、M的第一电离能由大到小的顺序是 (用元素符号表示)。
(3)下列有关上述元素的说法中,正确的是: (填序号)。
①B单质的熔点高于J单质,是因为B单质的金属键较强
②J比X活泼,所以J可以在溶液中置换出X
③将J2M2溶于水,要破坏离子键和共价键
④RA3沸点高于QA4,主要是因为前者相对分子质量较大
⑤一个Q2A4分子中含有五个σ键和一个![]() 键
键
(4)加拿大天文台在太空发现了AQ9R,已知分子中所有原子均形成8电子或2电子稳定结构,是直线型分子,不存在配位键。写出其结构式: 。
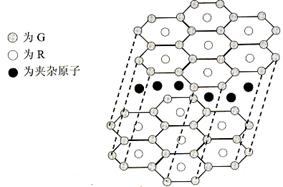
(5)B与R单质直接化合生成一种离子化合物B3R。该晶体具有类似石墨的层状结构。每层中,B原子构成平面六边形,每个六边形的中心有一个R原子。层与层之间还夹杂一定数量的原子。请问这些夹杂的原子应该是 (填B或R的元素符号)。
(6)元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同。第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的。但G的第一电离能却明显低于E,原因是 。
V、W、X、Y、Z五种短周期元素的原子序数依次增大,在周期表中W与V、X相邻,Y与Z相邻,X、Y同主族.Z的化合物可以发生某一反应,其离子方程式为:5________+ZO![]() +6H+3Z2+3H2O(未完成).
+6H+3Z2+3H2O(未完成).
(1)Y、Z两种元素的简单离子的半径大小关系为________(用离子符号表示).
(2)五种元素中分子的空间构型相同的氢化物沸点高低排列顺序为________(用分子式表示),其原因是________.
(3)V与Z单质不能直接化合生成VZ4,在催化剂作用下由VY2与Z2反应制得VZ4,其化学反应方程式为VY2+Z2→VZ4+Y2Z2(未配平).
①写出上述化学反应方程式________.
②Y2Z2分子中,Y与Z均满足8e-结构,则Y2Z2的结构式为________.
③Y与W两种元素形成一种重要化合物A,A分子的结构如图所示:

6 mol Y2Z2与16 mol W的简单氢化物恰好完全反应生成A、Y单质和一种中学化学中常见的盐.写出该反应的化学方程式:________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com