
题目列表(包括答案和解析)
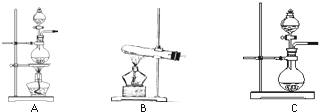 下表是实验室制备气体的有关内容:
下表是实验室制备气体的有关内容:| 编号 | 实验内容 | 实验原理 | 发生装置 |
| ① | 制氧气 | H2O2→O2 | C C |
| ② | 制氨气 | NH4Cl→NH3 | B B |
| ③ | 制氯气 | HCl→Cl2 | A或C A或C |
| ||
| ||
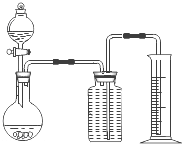
| 编号 | 实验内容 | 实验原理 | 发生装置 |
| (1) | 制氧气 | H2O2→O2 | C C |
| (2) | 制氨气 | NH4Cl→NH3 | B B |
| (3) | 制氯气 | HCl→Cl2 | A或C A或C |
| ||
| ||

(15分)下表是实验室制备气体的有关内容:
|
编号 |
实验内容 |
实验原理 |
发生装置 |
|
① |
制氧气 |
|
|
|
② |
制氨气 |
|
|
|
③ |
制氯气 |
|
|
(1)根据表中所列实验原理,从下列装置中选择合适的发生装置,将其编号填入上表的空格中。

(2)上述气体中,从反应中有无电子转移的角度看,明显不同于其他气体的是 ,写出实验室制取该气体的化学方程式 .
(3)若用上述制备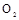 的装置制备
的装置制备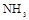 ,应选择的试剂为
.
,应选择的试剂为
.
(4)制备 需用
需用 的盐酸1OOml,现用
的盐酸1OOml,现用 的盐酸来配制。
的盐酸来配制。
①需要用量筒量取 的盐酸的体积为 mL;
的盐酸的体积为 mL;
②实验室提供有如下仪器,为完成配制需要选择的仪器为(填序号) 。
A.100mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶
E.lOmL量筒 F.胶头滴管 G.lOOmL烧杯 H.lOOmL容量瓶
③下列实验操作中,不正确的是 (填写标号)。
A.使用容量瓶前,检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,用量筒量取浓盐酸并沿玻璃棒倒入容量瓶中,缓慢加入蒸馏水到距离刻度线1~2cm处,改用胶头滴管滴加蒸馏水直到凹液面的最低点和刻度线相平
D.定容后盖好瓶塞,用食指顶住瓶塞,用另一只手托住瓶底,把容量瓶倒转和摇动多次
(15分)下表是实验室制备气体的有关内容:
| 编号 | 实验内容 | 实验原理 | 发生装置 |
| ① | 制氧气 |  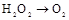 | |
| ② | 制氨气 | 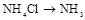 | |
| ③ | 制氯气 | 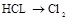 | |
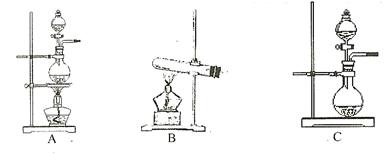
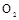 的装置制备
的装置制备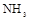 ,应选择的试剂为 .
,应选择的试剂为 .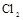 需用
需用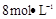 的盐酸1OOml,现用
的盐酸1OOml,现用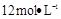 的盐酸来配制。
的盐酸来配制。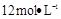 的盐酸的体积为 mL;
的盐酸的体积为 mL;湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com