
题目列表(包括答案和解析)
(9分)现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-、和NO3-的相互分离。相应的实验过程可用下图表示: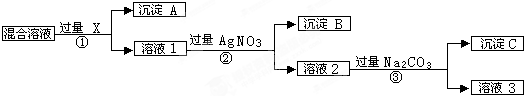
请回答下列问题:
(1)写出下列物质的化学式:试剂X _______,沉淀A_______,沉淀B 。
(2)上述实验流程中加入过量的Na2CO3的目的是(用离子方程式表示) :
。
(3)按此实验方案得到的溶液3中肯定含有___________(填化学式,下同)杂质。为了除去该杂质,可以向溶液3中加入适量的___________ ,若要获得固体NaNO3需进行的实验操作是________________。
(9分)现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-、和NO3-的相互分离。相应的实验过程可用下图表示:
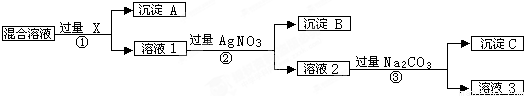
请回答下列问题:
(1)写出下列物质的化学式:试剂X _______,沉淀A_______,沉淀B 。
(2)上述实验流程中加入过量的Na2CO3的目的是(用离子方程式表示) :
。
(3)按此实验方案得到的溶液3中肯定含有___________(填化学式,下同)杂质。为了除去该杂质,可以向溶液3中加入适量的___________ ,若要获得固体NaNO3需进行的实验操作是________________。
纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。
(1)工业上二氧化钛的制备是: 资料卡片:
物质熔点SiCl4 -70 ℃ 、 TiCl4 -25 ℃;物质沸点SiCl457.6 ℃、TiCl4136.5 ℃
Ⅰ.将干燥后的金红石(主要成分TiO2,主要杂质SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2反应,制得混有SiCl4杂质的TiCl4。
Ⅱ.将SiCl4分离,得到纯净的TiCl4。
Ⅲ.在TiCl4中加水、加热,水解得到沉淀TiO2·xH2O。
Ⅳ.经过滤、水洗除去其中的Cl—,再烘干、焙烧除去水分得到粉体TiO2 。
①在常温下分离TiCl4与SiCl4所采取的操作名称是 ;
②Ⅲ中反应的化学方程式是 ;
③ 检验TiO2·x H2O中Cl-是否被除净的方法是______________________________。
(2)TiO2粒子的大小可以用现代分析仪器测定,而用氧化还原滴定法可测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+ ,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。回答下列问题:
①下列可用于测定TiO2粒子大小的方法是_____________________(填字母代号)。
a.核磁共振法 b.红外光谱法 c.质谱法 d.透射电子显微镜法
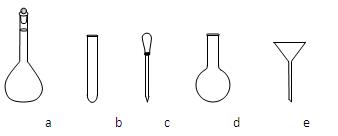
②配制NH4Fe(SO4)2标准溶液时,使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要下图中的_____(填字母代号)。
③滴定终点的现象是___________________________________________________。
④滴定分析时,称取TiO2(摩尔质量为M g·mol-1)试样w g,消耗c mol/L NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为_________________________。
⑤若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,对TiO2质量分数测定结果的影响_________________________。(填“偏高”、“偏低”或“无影响”)
纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。
(1)工业上二氧化钛的制备是: 资料卡片:
物质熔点SiCl4-70 ℃ 、 TiCl4 -25 ℃;物质沸点SiCl457.6 ℃、TiCl4136.5℃
Ⅰ.将干燥后的金红石(主要成分TiO2,主要杂质SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2反应,制得混有SiCl4杂质的TiCl4。
Ⅱ.将SiCl4分离,得到纯净的TiCl4。
Ⅲ.在TiCl4中加水、加热,水解得到沉淀TiO2·xH2O。
Ⅳ.经过滤、水洗除去其中的Cl—,再烘干、焙烧除去水分得到粉体TiO2 。
①在常温下分离TiCl4与SiCl4所采取的操作名称是 ;
②Ⅲ中反应的化学方程式是 ;
③ 检验TiO2·xH2O中Cl-是否被除净的方法是______________________________。
(2)TiO2粒子的大小可以用现代分析仪器测定,而用氧化还原滴定法可测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+ ,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。回答下列问题:
①下列可用于测定TiO2粒子大小的方法是_____________________(填字母代号)。
a.核磁共振法 b.红外光谱法 c.质谱法 d.透射电子显微镜法
②配制NH4Fe(SO4)2标准溶液时,使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要下图中的_____(填字母代号)。
③滴定终点的现象是___________________________________________________。
④滴定分析时,称取TiO2(摩尔质量为M g·mol-1)试样w g,消耗c mol/L NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为_________________________。
⑤若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,对TiO2质量分数测定结果的影响_________________________。(填“偏高”、“偏低”或“无影响”)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com