
题目列表(包括答案和解析)
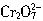 ,这些
,这些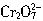 可以从过量的KI溶液中氧化出2.667gI2,反应的离子方程式为:
可以从过量的KI溶液中氧化出2.667gI2,反应的离子方程式为: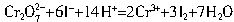
将KCl和CrCl3两种固体混合,共熔化合,制得化合物X,X是由K、Cr、Cl三种元素组成,将1.892g X中的Cr元素全部氧化成Cr2O72-,这些Cr2O72可以从过量的KI溶液中氧化生成2.667g碘单质,反应的离子方程式为:Cr2O72-+6I-+14H+![]() 2Cr3++3I2+7H2O,如果取溶有1.892g X的溶液,加入过量的AgNO3溶液,可以得到AgCl沉淀4.52g,则X的化学式为
2Cr3++3I2+7H2O,如果取溶有1.892g X的溶液,加入过量的AgNO3溶液,可以得到AgCl沉淀4.52g,则X的化学式为
A.K3Cr2Cl9 B.K3Cr2Cl7 C.K3Cr2Cl5 D.K2CrCl4
实验测得某溶液中仅含有K+、Cu2+、SO42—、Cl—四种离子,其中K+、Cu2+、Cl— 三种离子的个数比为4 : 5 : 8,则K+与SO42—的物质的量比为
A.4:3 B.4:1 C.2:3 D.2:1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com