
题目列表(包括答案和解析)
下列有关实验的做法或说法正确的是( )
A.在制备乙烯实验中,为防止反应过于剧列,加热时应使温度缓慢上升至170℃
B.向苯酚钠浓溶液中,不断通入足量二氧化碳气体,溶液最终不会出现浑浊现象
C.向溴乙烷滴入NaOH溶液后加热,待充分反应后,再加入AgNO3溶液后有浅黄色沉淀生成。
D.分别向三支盛有乙酸乙酯的试管中加入氢氧化钠溶液、稀硫酸、水,同时在水浴中加热,三支试管中香味持续时间按加入氢氧化钠、稀硫酸、水的顺序依次增长
下列转化关系所涉及的物质都是中学化学常见物质。已知A、B为氧化物,C为固体单质,D为黄绿色气体。
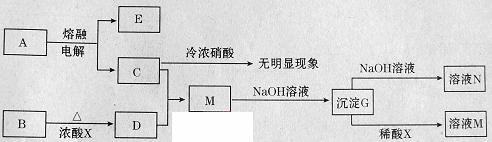
请回答:
(1)指出A中存在的化学键类型: 。
(2)写出M与过量氨水反应的离子方程式: 。
(3)向溶液N中先通入过量二氧化碳,再加入过量稀盐酸。观察到的现象是
_____________ ________。
(4)电解熔融氧化物A,阳极的电极反应方程式为 。
(5)B与浓酸X反应的化学方程式为 。
(6)能不能直接蒸发溶液M得到M晶体? (填“能”或“不能”)。若能,不用回答;若不能,回答该如何操作? 。
下列转化关系所涉及的物质都是中学化学常见物质。已知A、B为氧化物,C为固体单质,D为黄绿色气体。

请回答:
(1)指出A中存在的化学键类型: 。
(2)写出M与过量氨水反应的离子方程式: 。
(3)向溶液N中先通入过量二氧化碳,再加入过量稀盐酸。观察到的现象是
_____________ ________。
(4)电解熔融氧化物A,阳极的电极反应方程式为 。
(5)B与浓酸X反应的化学方程式为 。
(6)能不能直接蒸发溶液M得到M晶体? (填“能”或“不能”)。若能,不用回答;若不能,回答该如何操作? 。
(8分)现有以下四种溶液;①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液.请回答下列问题:
(1) ②④溶液中由水电离出来的c(H+)的关系是:② ④(填“>”“<”或“=”).
(2) 将②③溶液等体积混合后,溶液的pH 7 (填“>”“<”或“:”). ,
(3)将①④溶液均稀释至原来的10倍后,它们的pH之和 14(填“>”“<”或“=”).
(4)向300 mL溶液④中通入44.8 mL C02(标准状况)气体,充分反应后,溶液中粒子浓度关系正确的是 ( )
A、c(Na+)+ c(H+)=c(OH—)+ c(HCO3—)+ 2c(CO32—)
B、![]() c(Na+)= c(HCO3—)+c(CO32—)+ c(H2CO3)
c(Na+)= c(HCO3—)+c(CO32—)+ c(H2CO3)
C、c(Na+)>c(CO32—)> c(HCO3—)> c(OH—)>c(H+)
D、c(Na+)>c(HCO3—)> c(CO32—)> c(OH—)>c(H+)
【解析】(1)水属于弱电解质,存在电离平衡:H2OH++OH—。所以不论是酸还是碱均是抑制水的电离,②和④中氢离子和OH—的的浓度均相同,抑制水的电离程度是相同的,所以由水电离出来的c(H+)是相同的。
(2)盐酸的浓度是0.01mol/L,氨水是弱电解质,所以其浓度大于0.01mol/L,因此反应后氨水是过量的,溶液显碱性,pH大于7.
(3)。强碱每稀释10n倍,强碱的pH就减小n个单位,所以pH=12的氢氧化钠稀释10倍,pH=11。但醋酸是弱电解质,稀释10倍后溶液的pH将大于3,所以它们的pH之和小于14.
(4)300mlpH=12的氢氧化钠,其物质的量是0.01mol/L×0.3L=0.003mol。44.8 mL C02(标准状况)气体的物质的量是0.002mol,所以二者混合反应后生成物是碳酸钠和碳酸氢钠的混合液,其中二者的物质的量均是0.001mol。CO32-的水解程度大于HCO3-的水解程度,所以选项C错误,D正确。选项A符合电荷守恒,选项B符合物料守恒,均正确。
(8分)现有以下四种溶液;①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液.请回答下列问题:
(1) ②④溶液中由水电离出来的c(H+)的关系是:② ④(填“>”“<”或“=”).
(2) 将②③溶液等体积混合后,溶液的pH 7 (填“>”“<”或“:”). ,
(3)将①④溶液均稀释至原来的10倍后,它们的pH之和 14(填“>”“<”或“=”).
(4)向300 mL溶液④中通入44.8 mL C02(标准状况)气体,充分反应后,溶液中粒子浓度关系正确的是 ( )
A、c(Na+)+ c(H+)= c(OH—)+ c(HCO3—)+ 2c(CO32—)
B、 c(Na+)= c(HCO3—)+
c(CO32—)+ c(H2CO3)
c(Na+)= c(HCO3—)+
c(CO32—)+ c(H2CO3)
C、c(Na+)> c(CO32—)> c(HCO3—)> c(OH—)> c(H+)
D、c(Na+)> c(HCO3—)> c(CO32—)> c(OH—)> c(H+)
【解析】(1)水属于弱电解质,存在电离平衡:H2O H++OH—。所以不论是酸还是碱均是抑制水的电离,②和④中氢离子和OH—的的浓度均相同,抑制水的电离程度是相同的,所以由水电离出来的c(H+)是相同的。
H++OH—。所以不论是酸还是碱均是抑制水的电离,②和④中氢离子和OH—的的浓度均相同,抑制水的电离程度是相同的,所以由水电离出来的c(H+)是相同的。
(2)盐酸的浓度是0.01mol/L,氨水是弱电解质,所以其浓度大于0.01mol/L,因此反应后氨水是过量的,溶液显碱性,pH大于7.
(3)。强碱每稀释10n倍,强碱的pH就减小n个单位,所以pH=12的氢氧化钠稀释10倍,pH=11。但醋酸是弱电解质,稀释10倍后溶液的pH将大于3,所以它们的pH之和小于14.
(4)300mlpH=12的氢氧化钠,其物质的量是0.01mol/L×0.3L=0.003mol。44.8 mL C02(标准状况)气体的物质的量是0.002mol,所以二者混合反应后生成物是碳酸钠和碳酸氢钠的混合液,其中二者的物质的量均是0.001mol。CO32-的水解程度大于HCO3-的水解程度,所以选项C错误,D正确。选项A符合电荷守恒,选项B符合物料守恒,均正确。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com