
题目列表(包括答案和解析)
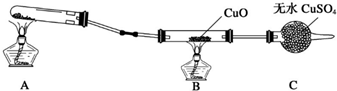
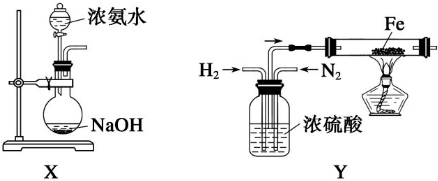

 MnCl2+Cl2+2H2O
MnCl2+Cl2+2H2O MnCl2+Cl2+2H2O
MnCl2+Cl2+2H2O

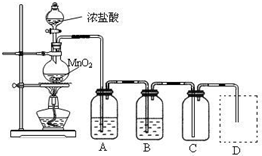
| 实验方法 | 实验现象 | 结论 |
| 在溶液中加 KSCN溶液 |
溶液为红色 溶液为红色 |
固体物质中有FeCl3 |
| 向a溶液中滴加 酸性KMnO4溶液 |
KMnO4溶液紫色 不褪色 |
固体物质中不含 固体物质中不含 FeCl2 固体物质中不含 FeCl2 |
表是某地区市场上销售的一种“加碘食盐”包装袋上的部分文字说明。请根据此表,结合化学和生物学科的知识,回答下列问题。
配料表 | 精制海盐、碘酸钾 |
含碘量 | 20~40mg/kg |
卫生许可证号 | ××卫碘字(1999)第001号 |
分装日期 | 见封底 |
储藏方法 | 密封、避光、防潮 |
食用方法 | 烹调时,待食品熟后加入碘盐 |
(1)要在食盐中加碘,是因为碘是人体内合成_______激素的主要原料,缺碘会引起疾病。
(2)食盐中加碘,这里碘指的是 ,其中碘元素的化合价为________。
(3)根据含碘盐的食用方法可推测碘元素的化学性质,碘酸钾在受热时容易___________。
(4)辨别真假碘盐时,可将盐撒在淀粉溶液或切开的马铃薯切面上,以下判断正确的是? ( )
A.如显出绿色,是真碘盐 B.如显出红色,是真碘盐
C.如显出蓝色,是真碘盐 D.如显出黄色,是真碘盐
(5)国家规定每千克食盐中应含有40~50mg的碘酸钾。为了检验某食盐是否加碘,某同学取食盐样品428g,设法溶解出其中全部的碘酸钾,将溶液酸化并加入足量的碘化钾淀粉溶液,溶液呈蓝色,再用0.03mol?L-1的硫代硫酸钠溶液滴定,用去18.00mL时蓝色刚好褪去。试通过计算说明该加碘食盐是否为合格产品。有关反应如下:IO3-+5I-+6H+→3I2+3H2O;
I2+2S2O32-→2I-+S4O62-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com