
题目列表(包括答案和解析)
下列是某同学对相应反应的离子方程式所作的评价,其中评价完全合理的是( )
|
| 编号 | 化学反应 | 离子方程式 | 评价 |
| ① | Cu和AgNO3溶液反应 | Cu++Ag+=Cu2++Ag | 正确 |
| ② | 氧化铝与NaOH溶液反应 | 2Al3++3O2-+2OH-=2AlO2-+H2O | 错误,Al2O3不应写成离子形式 |
| ③ | Fe和稀硫酸反应 | 2Fe+6H+=2Fe3++3H2↑ | 正确 |
| ④ | 钠与硫酸铜溶液反应 | 2Na+Cu2+=Cu+2Na+ | 错误,CuSO4不应写成离子形式 |
| A.只有② | B.①③ | C.②④ | D.①②③④ |
| 7(W2-W1) |
| a |
| 7(W2-W1) |
| a |
| ||
 某化学兴趣小组欲研究一种镁铝合金,以下是部分实验.请完成填空.
某化学兴趣小组欲研究一种镁铝合金,以下是部分实验.请完成填空.| 方法 | 需测定的数据 |
| ① | 测定产生的H2的体积 |
| ② |
.某化学兴趣小组测定某FeCl3样品(只含少量FeCl2杂质)中铁元素的质量分数,按以下实验步骤进行操作:
① 称取a g样品,置于烧杯中;
② 加入适量盐酸和蒸馏水,使样品溶解,然后准确配制成250.00mL溶液;
③量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,使反应完全;
④ 加入过量氨水,充分搅拌,使沉淀完全;
⑤ 过滤,洗涤沉淀;
⑥ 将沉淀转移到某容器内,加热、搅拌,直到固体由红褐色全部变为红棕色后,在干燥器中冷却至室温后,称量;
⑦……。

请根据上面叙述,回答:
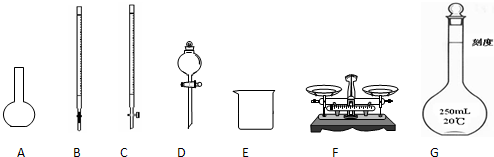
(1)上图所示仪器中,本实验步骤①②③中必须用到的仪器是E和 (填字母)。
(2)写出步骤④中发生反应的离子方程式 。
(3)样品中的杂质Fe2+有较强的还原性,完成并配平下列反应的离子方程式
Fe2+ + ClO3—+ = Fe3+ + Cl—+ H2O
从理论上分析,上述实验中若将氯水改为NaClO3时,对实验结果造成 (填偏大、偏小或不影响),
(4)若容器质量是W1 g,最终容器和固体的总质量是W2 g,则样品中铁元素的质量分数为 。(列出算式,不需化简)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com