
题目列表(包括答案和解析)
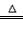 2CaSO4+2Cl2↑+2H2O。某学习小组利用此反应原理设计如图所示装置制取氯气并探究其性质。
2CaSO4+2Cl2↑+2H2O。某学习小组利用此反应原理设计如图所示装置制取氯气并探究其性质。 
工业上制取漂白粉的化学方程式为________,漂白粉的主要成分是________;其有效成分是________.漂白粉溶于水发生漂白作用的化学方程式是________,久置的漂白粉由于和空气中的________反应而变为________.
漂白粉常用作消毒剂、杀菌剂、漂白剂等。工业上是把氯气通入含水略少于1 %(质量分数)的消石灰中制得漂白粉。漂白粉是一种混合物,其有效成分是Ca(ClO)2,商品漂白粉中往往含有Ca(OH)2、CaCl2、H2O等杂质。漂白粉质量高低由“有效氯”(过量浓盐酸与漂白粉作用生成的氯气的质量与漂白粉的质量比)和它保持有效氯的时间来决定的。
⑴ 现称取某漂白粉4.00 g配制成500 mL溶液,准确吸取其中25.00 mL后,加入足量的足量浓盐酸和KI溶液,静置。待反应产生的氯气与KI完全反应后,用0.100 mol/L的Na2S2O3溶液滴定(2Na2S2O3+I2=Na2S4O6+2NaI),到达终点时消耗20.00 mLNa2S2O3溶液。计算该漂白粉中有效氯的百分含量。
⑵ 某研究性学习小组用上述方法测得一种漂白粉的有效氯为56%。请根据推理和计算判断该实验结果是否准确。
⑶ 某品牌漂白粉的组成可表示为Ca(OH)2·3CaCl(OCl)·nH2O,有效氯为35%,n= 。
碱式碳酸铜和氯气都是用途广泛的化工原料。
(1)工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H +、Cl?)制备碱式碳酸铜,其制备过程如下:

已知:Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
物质 | Cu(OH)2 | Fe (OH)2 | Fe (OH)3 |
开始沉淀pH | 4.2 | 5.8 | 1.2 |
完全沉淀pH | 6.7 | 8.3 | 3.2 |
①氯酸钠的作用是???????????? ;
②反应A后调节溶液的pH范围应为?????????????????????????? 。
③第一次过滤得到的产品洗涤时,如何判断已经洗净????????????????????? 。
④造成蓝绿色产品中混有CuO杂质的原因是???????????????????? 。
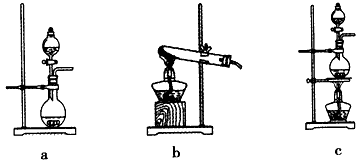
(2)某学习小组在实验室中利用下图所示装置制取氯气并探究其性质。
①实验室用二氧化锰和浓盐酸加热制取氯气,所用仪器需要检漏的有??? ????????? ????? 。
②若C中品红溶液褪色,能否证明氯气与水反应的产物有漂白性,说明原因 ????????? ?? 。此时B装置中发生反应的离子方程式是___________?????????????? _____。
③写出A溶液中具有强氧化性微粒的化学式????????? ??????????????????? ?? 。若向A溶液中加入NaHCO3粉末,会观察到的现象是????????????????????? 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com