金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝.高温下,在密闭容器中用H
2还原WO
3可得到金属钨,其总反应为:
WO
3 (s)+3H
2 (g)
W (s)+3H
2O (g)
请回答下列问题:
(1)在一定温度下进行上述反应,若反应容器的容积为0.5L,2min后达到平衡,测得固体的质量减少了4.80g,则H
2的平均反应速率
0.3 mol/(L?min)
0.3 mol/(L?min)
;该反应的平衡常数表达式K=
(2)某温度下反应达平衡时,H
2与水蒸气的体积比为2:3,则H
2的平衡转化率为
60%
60%
;随温度的升高,H
2与水蒸气的体积比减小,则该反应为
正反应吸热
正反应吸热
(填“吸热”或“放热”) 反应.
(3)一定温度下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是
CD
CD
.
A.混合气体的总压强保持不变 B.v
正(H
20)=v
正(H
2)
C.混合气体的密度保持不变 D. 混合气体的平均式量保持不变
(4)钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I
2可延长灯管的使用寿命,其工作原理为:W (s)+2I
2 (g)
WI
4 (g).下列说法正确的有
BD
BD
.
A.温度升高时,WI
4的分解速率加快,W和I
2的化合速率减慢
B.WI
4在灯丝上分解,产生的W又沉积在灯丝上
C.WI
4在灯管壁上分解,使灯管的寿命延长
D.灯管内的I
2可循环使用.

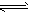 2HI(g);△H>0(正反应为吸热反应)。在一带有活塞的密闭容器中达到平衡,下列说法中不正确的是
2HI(g);△H>0(正反应为吸热反应)。在一带有活塞的密闭容器中达到平衡,下列说法中不正确的是