
题目列表(包括答案和解析)
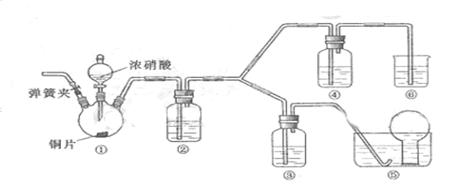
某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行实验(夹持仪器已略去)。实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
可选药品:浓硝酸、3mol/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
已知:氢氧化钠溶液与NO不反应,能与NO2反应2NO2+2NaOH=NaNO3+ NaNO2+H2O
(1)实验应避免有害气体排放到空气中,装置③、⑥中盛放的药品依次是
(2)滴加浓硝酸之前的操作是检验装置的气密性,加入药品后,还应进行哪些操作
再滴加浓硝酸与铜反应。
(3)装置①中发生反应的化学方程式是
(4)装置②的作用是 ,发生反应的化学方程式是
(5)该小组得出的结论依据的实验现象是
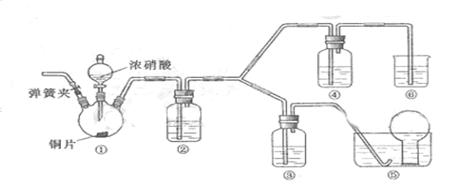
某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行实验(夹持仪器已略去)。实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。

可选药品:浓硝酸、3mol/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
已知:氢氧化钠溶液与NO不反应,能与NO2反应2NO2+2NaOH=NaNO3+ NaNO2+H2O
(1)实验应避免有害气体排放到空气中,装置③、⑥中盛放的药品依次是
(2)滴加浓硝酸之前的操作是检验装置的气密性,加入药品后,还应进行哪些操作
再滴加浓硝酸与铜反应。
(3)装置①中发生反应的化学方程式是
(4)装置②的作用是 ,发生反应的化学方程式是
(5)该小组得出的结论依据的实验现象是
某化学实验室需要0.2mol/L NaOH溶液500 mL和0.5 mol/L硫酸溶液450 mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是 (填序号),配制上述溶液还需用到的玻璃仪器是 (填仪器名称)。
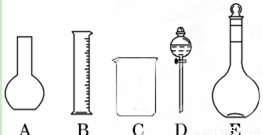
(2)容量瓶是配制溶液的主要仪器,容量瓶上标有以下六项中的___________(填写序号)。
①温度 ②浓度 ③容量 ④压强 ⑤酸式或碱式 ⑥刻度线
(3)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次) 。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约50mL),用玻璃棒慢慢搅动,使其充分溶解,冷却到室温
C.将容量瓶盖紧,摇匀
D.将溶解的氢氧化钠溶液沿玻璃棒注入容量瓶中
E.改用胶头滴管加水,使溶液凹液面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度2~3cm处
(4)根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为: mL(计算结果保留一位小数)。
(5)配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是:_________________。
(6)将所配制的稀H2SO4进行测定,发现实际浓度小于0.5mol/L。请你分析下列哪些操作会引起所配浓度偏小(填写字母) 。
A.用量筒量取浓硫酸时,仰视量筒的刻度
B.容量瓶未干燥即用来配制溶液
C.浓硫酸在烧杯中稀释后,未冷却就立即转移到容量瓶中,并进行定容
D.往容量瓶转移时,有少量液体溅出
E.在容量瓶中定容时俯视容量瓶刻度线
F.烧杯未进行洗涤
G.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线。
某化学实验室需要0.2mol/L NaOH溶液500 mL和0.5 mol/L硫酸溶液450 mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是 (填序号),配制上述溶液还需用到的玻璃仪器是 (填仪器名称)。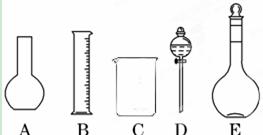
(2)容量瓶是配制溶液的主要仪器,容量瓶上标有以下六项中的___________(填写序号)。
①温度 ②浓度 ③容量 ④压强 ⑤酸式或碱式 ⑥刻度线
(3)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次) 。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约50mL),用玻璃棒慢慢搅动,使其充分溶解,冷却到室温
C.将容量瓶盖紧,摇匀
D.将溶解的氢氧化钠溶液沿玻璃棒注入容量瓶中
E.改用胶头滴管加水,使溶液凹液面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度2~3cm处
(4)根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为: mL(计算结果保留一位小数)。
(5)配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是:_________________。
(6)将所配制的稀H2SO4进行测定,发现实际浓度小于0.5mol/L。请你分析下列哪些操作会引起所配浓度偏小(填写字母) 。
A.用量筒量取浓硫酸时,仰视量筒的刻度
B.容量瓶未干燥即用来配制溶液
C.浓硫酸在烧杯中稀释后,未冷却就立即转移到容量瓶中,并进行定容
D.往容量瓶转移时,有少量液体溅出
E.在容量瓶中定容时俯视容量瓶刻度线
F.烧杯未进行洗涤
G.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com