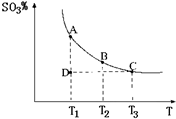
(2011?松江区模拟)运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义.
(1)硫酸生产中,SO
2催化氧化生成SO
3:2SO
2(g)+O
2(g)

2SO
3(g),混合体系中SO
3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:
①2SO
2(g)+O
2(g)

2SO
3(g)是
放热
放热
反应(填吸热或放热);若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡
向左
向左
移动(填“向左”、“向右”或“不”);②若温度为T
1、T
2,反应的平衡常数分别为K
1、K
2,则K
1>
>
K
2;若反应进行到状态D时,V
正>
>
V
逆(填“>”、“<”或“=”)
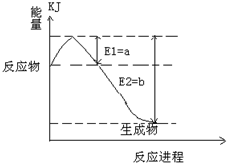
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.
①如图是一定的温度和压强下是N
2和H
2反应生成1molNH
3过程中能量变化示意图,请写出工业合成氨的热化学反应方程式:
N2(g)+3H2(g)?2NH3(g)△H=-2(b-a)kJ?mol-1
N2(g)+3H2(g)?2NH3(g)△H=-2(b-a)kJ?mol-1
.(热量Q的数值用含字母a、b的代数式表示)
(3)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在.在25°C下,向0.1mol?L
-1的NaCl溶液中逐滴加入适量的0.1mol?L
-1硝酸银溶液,有白色沉淀生成,向反应后的浊液中,继续加入0.1mol?L
-1的NaI溶液,看到的现象是
白色沉淀转化为黄色沉淀
白色沉淀转化为黄色沉淀
,产生该现象的原因是(用离子方程式表示)
AgCl(s)+I-═AgI(s)+Cl-
AgCl(s)+I-═AgI(s)+Cl-
.
(25°C时AgCl和AgI的离子积常数K
SP为:K
SP[AgCl]=1.0×10
-10 mol
2?L
-2,K
SP[AgI]=1.5×10
-16 mol
2?L
-2)

 (2011?松江区模拟)运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义.
(2011?松江区模拟)运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义. 2SO3(g),混合体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:
2SO3(g),混合体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题: 2SO3(g)是
2SO3(g)是