
题目列表(包括答案和解析)
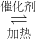 7N2(g)+12H2O(g)也可处理NO2.则化学平衡常数表达式K=______;当转移1.2mol电子时,消耗的NO2在标准状况下是______L.
7N2(g)+12H2O(g)也可处理NO2.则化学平衡常数表达式K=______;当转移1.2mol电子时,消耗的NO2在标准状况下是______L.| 反应时间/min | n(CO)/mol | H2O/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| 测定时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水样品的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
 7N2(g)+12H2O(g)也可处理NO2。则化学平衡常数表达式K=______;当转移1.2mol电子时,消耗的NO2在标准状况下是_______L。
7N2(g)+12H2O(g)也可处理NO2。则化学平衡常数表达式K=______;当转移1.2mol电子时,消耗的NO2在标准状况下是_______L。 
 CO2+H2(g) 反应过程中测定的部分数据见下表(表中t1>t2)
CO2+H2(g) 反应过程中测定的部分数据见下表(表中t1>t2) 

| |||||||||||||||||||||||||||||
 ”表示在空气中形成酸雨的两条途径:
”表示在空气中形成酸雨的两条途径:(10分)2010年上海世博会主题是“城市,让生活更美好”,试回答下列问题:
(1)为确保世博会期间申城空气质量优良率达到95%以上,世博会期间的空气质量状况监测中,不需要监测的指标是_____________。
a.可吸入颗粒物(PM10) b.NO2浓度 c.SO2浓度 d.CO2浓度;
(2)造成臭氧层空洞的主要物质是_______________。为了改善空气质量,必须控制大气中二氧化硫、氮氧化物、烟尘等污染物的排放量。对汽车加装尾气催化净化装置,使其中的有害气体NO、CO转化为无害气体,该反应的化学方程式为__________。
(3)为2010年世博会期间提供科学有效的环境质量保障方案,白龙港污水处理厂升级改造,处理废水时加入K2SO4·Al2(SO4)3·24H2O或碱式氯化铝的作用是____________;通入臭氧或二氧化氯的作用是______________。某农村地区为获得饮用水,在将地表水取回家后,常使用漂白粉或漂白精片进行杀菌消毒,其原理可用化学方程式表示为_________________________。
(4)世博会中国馆——“东方之冠”,它由钢筋混凝土、7000多块红色铝板和1200多块玻璃等建成。生产玻璃所用的工业设备是 ;石英玻璃化学稳定性强、膨胀系数小,是一种特种玻璃,石英玻璃的主要成分是 ;
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com