
题目列表(包括答案和解析)
| 1 H 氢 |
 |
2 He 氦 | ||||||
| 3 Li 锂 |
4 Be 铍 |
5 B 硼 |
6 C 碳 |
7 N 氮 |
8 O 氧 |
9 F 氟 |
10 Ne 氖 | |
| 12 Mg 镁 |
13 A1 铝 |
14 Si 硅 |
15 P 磷 |
16 S 硫 |
X C1 氯 |
18 Ar 氩 | ||
 所表示的粒子符号是
所表示的粒子符号是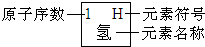 元素周期律是学习和研究化学的重要工具.下表是元素周期表的部分信息
元素周期律是学习和研究化学的重要工具.下表是元素周期表的部分信息| 1 H 氢 | 2 He 氦 | ||||||
| 3 Li 锂 | 4 Be 铍 | 5 B 硼 | 6 C 碳 | 7 N 氮 | 8 O 氧 | 9 F 氟 | 10 Ne 氖 |
| 11 Na 钠 | 12 Mg 镁 | 13 A1 铝 | 14 Si 硅 | 15 P 磷 | 16 S 硫 | X C1 氯 | 18 Ar 氩 |
| 19 K 钾 | 20 Ca 钙 | … | |||||
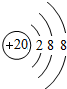 表示的是(写粒子符号)______.
表示的是(写粒子符号)______.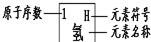 元素周期律是学习和研究化学的重要工具.下表是元素周期表的部分信息:认真分析信息,回答:
元素周期律是学习和研究化学的重要工具.下表是元素周期表的部分信息:认真分析信息,回答:| 1 H 氢 | 2 He 氦 | |||||||
| 3 Li 锂 | 4 Be 铍 | 5 B 硼 | 6 C 碳 | 7 N 氮 | 8 O 氧 | 9 F 氟 | 10 Ne 氖 | |
| 1l Na 钠 | 12 Mg 镁 | 13 A1 铝 | X Si 硅 | 15 P 磷 | 16 S 硫 | 17 C1 氯 | 18 Ar 氩 | |
| 19 K 钾 | 20 Ca 钙 | … | ||||||
 表示的是(写粒子符号):______
表示的是(写粒子符号):______分析:本选择题可采用直接法解答,即通过分析和计算而得出答案。
本题是同质量的不同金属与相同质量酸的反应。有下面几种情况,如果酸过量金属完全反应,则相同质量的不同金属与同质量的酸反应后生成后的质量肯定不同,天平不能保持平衡;如果金属过量酸完全反应,产生H2的质量必相同,此时天平必保持平衡。
设酸完全反应。
Zn+H2SO4=ZnSO4+H2↑
65g 98g
x 98×10%g x=6.5(g)
Mg+H2SO4=MgSO4+H2↑
24g 98g
y 98×10% y=2.4(g)
当Zn等于或大于6.5g时,Mg等于或大于2.4g,即保持酸过量的条件。答案:D
(7分)甲、乙、丙、X是初中化学常见的四中物质.它们的转化关系如图所示(部分产物略去,图中“”表示甲和丙都能与X反应生成乙).
(1)若甲为二氧化碳,乙为一氧化碳,丙为氧气.
①X的化学式为 .
②甲、乙、丙三种气体中有毒的是 .
(2)若甲为碳酸氢钠,乙为氯化钠,丙为碱.
①丙的名称为 .
②物质X (“能”或“不能”)清除铁制品表面的锈.
(3)若X为石灰水,甲为碳酸钠,丙为气体.
①X与甲的溶液反应,其反应的类型是 .
②丙与足量X反应的化学方程式为 .
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com