
题目列表(包括答案和解析)
已知:![]() +Cl2=Br2+
+Cl2=Br2+![]()
5Cl2+I2+6H2O=2HIO3+10HCl
![]() +5Cl-+6H+=3Cl2↑+3H2O
+5Cl-+6H+=3Cl2↑+3H2O
下列物质氧化性由强到弱的顺序正确的是
[ ]
A.![]() >
>![]() >
>![]() >Cl2
>Cl2
B.![]() >
>![]() >Cl2>
>Cl2>![]()
C.![]() >Cl2>
>Cl2>![]() >
>![]()
D.Cl2>![]() >
>![]() >
>![]()
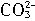 =
=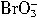 +5Br-+3CO2↑;③
+5Br-+3CO2↑;③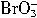 +5Br-+6H+=3Br2+3H2O。
+5Br-+6H+=3Br2+3H2O。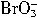 氧化性从强到弱的顺序为:__________。
氧化性从强到弱的顺序为:__________。②5 Cl2+ I2+6 H2O ====2HIO3+10HCl
③![]() +5Cl+6H+====3Cl2+3H2O,下列微粒氧化性强弱顺序正确的是( )
+5Cl+6H+====3Cl2+3H2O,下列微粒氧化性强弱顺序正确的是( )
A.![]() <
<![]() <Cl2<
<Cl2<![]() B.
B.![]() <
<![]() <
<![]() < Cl2
< Cl2
C.![]() >
>![]() > Cl2>
> Cl2>![]() D.
D.![]() >
>![]() >Cl2
>Cl2
(1)在标准状况下,有下列物质①4gH2,②33.6LCH4, ③1molH2O,④3.01×1023个O2。其
中含分子数最多的是(填序号,下同) ,质量最大的是 ,体积最小的 ;密度由大到小的顺序为 。
(2)实验室从海藻(含碘元素,以碘离子的形式存在)中提取碘的流程如下:
已知2KI+Cl2=2KCl+I2,步骤④的目的是从含碘的有机溶液中分离出单质碘和回收有机溶液。w.w.^w.k.&s.5*u.c.#om高.考.资.源.网
I.提取碘的过程中有关的实验操作名称:③ 。
II.有下列实验仪器:A.烧杯 B.玻璃棒 C.表面皿 D.分液漏斗 E.酒精灯
步骤①中必须用到的有(填序号) ,还缺少的玻璃仪器有 。
III.提取碘的过程中,选用的萃取剂可以是 。
A.四氯化碳 B.汽油 C.酒精 D.醋酸
(3)写出实验室制取氯气的化学方程式 。w.w.^w.k.&s.5*u.c.#om高.考.资.源.网
(8分)阅读下列材料后,回答相应问题。
一个体重50Kg的健康人大约含铁2g,这2g铁在人体中不是以单质金属形式存在,而是以Fe2+和Fe3+的形式存在。二价铁离子易被吸收,给贫血者补充铁时,应给予含二价铁离子的二价铁盐,如硫酸亚铁(FeSO4)。服用维生素C,可使食物中的三价铁离子还原成二价铁离子,有利于铁的吸收。
(1)人体中经常进行的相互转化,在A过程中,Fe2+做 剂,在B过程中,Fe3+做 剂。
(2)“服用维生素C,可使食物中三价铁离子还原成二价铁离子。”这句话指出,维生素C在这一反应中做 _剂,具有 性。
(3)已知:氧化性Cl2 > Br2 > Fe3+,还原性Fe2+ >Br- >Cl-,则向0.2mol/L 1LFeBr2溶液中通入标准状况下氯气2.24L,被氧化的粒子是 ,此反应的离子方程式: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com