(2009?安徽模拟)某化学研究性学习小组为探究元素性质的变化规律,设计了如下实验:
(1)甲同学根据同周期元素原子结构的变化规律,预测出同一周期,从左至右元素的金属性逐渐减弱.请你根据实验室常用试剂和仪器帮助甲同学设计实验,简述实验步骤和现象(以第三周期元素为例):
分别取钠、镁、铝小粒分别与冷水反应,钠剧烈反应,镁和铝无明显现象;另取镁、铝小粒分别与等浓度的盐酸反应,镁比铝反应剧烈
分别取钠、镁、铝小粒分别与冷水反应,钠剧烈反应,镁和铝无明显现象;另取镁、铝小粒分别与等浓度的盐酸反应,镁比铝反应剧烈
.
(2)乙同学欲比较N、C、Si的非金属性强弱,设计了图1所示的实验装置,其能否达到实验目的
能
能
(填“能”或“不能”),设计的理论依据是
元素的非金属性越强,其最高价氧化物的水合物酸性越强
元素的非金属性越强,其最高价氧化物的水合物酸性越强
. 但也有同学根据硝酸具有挥发性,认为乙同学的实验装置存在不足,请你帮助该同学提出修改意见
在两导管之间连接一个装有饱和碳酸钠的洗气瓶
在两导管之间连接一个装有饱和碳酸钠的洗气瓶
.
(3)丙同学从资料中获悉:元素周期表中处于象硼与硅这样“对角线”位置的某些元素性质相似.预测金属铍应该具有与
铝
铝
相似的性质,能证明其预测的实验方案是
铍单质分别与酸和强碱反应,看反应现象
铍单质分别与酸和强碱反应,看反应现象
.
(4)丁同学设计了如图2装置验证元素性质递变规律.A、B、C处分别是蘸有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气.丁同学可能观察到的现象有
A:白色变成黄色或橙黄色;B:变蓝色;C:红纸褪色
A:白色变成黄色或橙黄色;B:变蓝色;C:红纸褪色
. 从环保角度考虑,该装置有明显不足,请指出并提出改进建议
尾气排入空气污染环境,应在试管口处放一团浸有氢氧化钠溶液的棉花
尾气排入空气污染环境,应在试管口处放一团浸有氢氧化钠溶液的棉花
.


 ,则在其脱水产物H6Si2O7分子结构中,含有硅氧键的数目为( )
,则在其脱水产物H6Si2O7分子结构中,含有硅氧键的数目为( ) ![]() .已知原硅酸的结构式为
.已知原硅酸的结构式为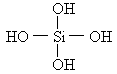 ,则在所得的
,则在所得的![]() 分子中含有的硅氧键数目为
分子中含有的硅氧键数目为![]() (焦硅酸)+
(焦硅酸)+ .已知原硅酸的结构式为
.已知原硅酸的结构式为 ,则在所得的
,则在所得的 分子中含有的硅氧键数目为
分子中含有的硅氧键数目为