(2011?晋中三模)请回答下列问题:
(1)现代工业将煤炭气化,既可以提高燃料的利用率、减少CO、SO
2等的排放,又可以扩大水煤气的广泛用途.
①已知:2C(s)+O
2(g)=2CO(g);△H
1,2H
2(g)+O
2(g)=2H
2O(g);△H
2.
则反应C(s)+H
2O(g)?CO(g)+H
2(g);△H=
.(用含△H
1、△H
2的代数式表示)
②CO和H
2在一定条件下合成甲醇的反应为:CO(g)+2H
2(g)?CH
3OH(g);△H
3.现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1mol CO和2mol H
2的混合气体,控温,进行实验,测得相关数据如下图1和图2.
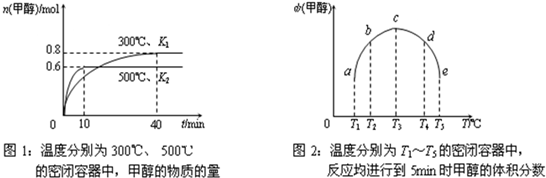
a.该反应的△H
3<
<
0(选填“<”、“>”或“=”,下同),K
1>
>
K
2.
b.将容器d中的平衡状态转变到容器c中的平衡状态,可采取的措施有
升温、减压
升温、减压
.
(2)某燃料电池以熔融态K
2CO
3为电解质,一极通入CO,另一极通入空气和CO
2的混合气体.已知该燃料电池正极反应为2CO
2+O
2+4e
-=2CO
32-;则其负极的电极反应式为
CO+CO32--2e-=2CO2
CO+CO32--2e-=2CO2
.
(3)图3为某温度下,Fe(OH)
3(s)、Mg(OH)
2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液的pH,金属阳离子浓度变化情况.据图分析:
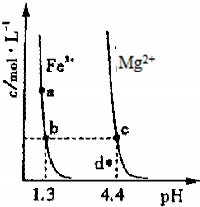
该温度下,溶度积常数的关系为:Ksp[Fe(OH)
3]
<
<
Ksp[Mg(OH)
2]
(填:>、=、<);如果在新生成的Mg(OH)
2浊液中滴入足量的Fe
3+,振荡后,白色沉淀会全部转化为红褐色沉淀,原因是
由于Ksp[Fe(OH)3]<Ksp[Mg(OH)2],浊液中存在溶解平衡:Mg(OH)2?Mg2++2OH-,当加入Fe3+后与OH-生成更难溶解的Fe(OH)3,使平衡继续向右移动,最后Mg(OH)2全部溶解转化为红棕色的Fe(OH)3.
由于Ksp[Fe(OH)3]<Ksp[Mg(OH)2],浊液中存在溶解平衡:Mg(OH)2?Mg2++2OH-,当加入Fe3+后与OH-生成更难溶解的Fe(OH)3,使平衡继续向右移动,最后Mg(OH)2全部溶解转化为红棕色的Fe(OH)3.
.



