(2012?和平区一模)铬(Cr)属于重金属元素,含铬废水和废渣排放必须经过处理达到有关的安全标准.
(1)含铬废水排放到河水中一定浓度会使鱼类等水生动物死亡的原因是
重金属离子会使蛋白质变性
重金属离子会使蛋白质变性
.
常用的处理方法有两种.
方法1:还原沉淀法
该法用FeSO
4将以Cr
2O
72-的形式存在于酸性废水中的铬元素还原为Cr
3+,再用沉淀法进行分离.已知:
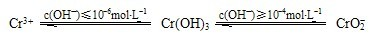
(2)FeSO
4还原Cr
2O
72-的离子方程式为
Cr2O72-+6Fe2++14H+=3Cr3++6Fe3++7H2O
Cr2O72-+6Fe2++14H+=3Cr3++6Fe3++7H2O
.
(3)Cr
2(SO
4)
3溶液中加入过量NaOH浓溶液,反应的离子方程式为
Cr3++4OH-=CrO2-+2H2O
Cr3++4OH-=CrO2-+2H2O
.
(4)沉淀法分离废水中的Cr
3+离子,pH应控制在
8~10
8~10
范围内.
(5)下列关于铬及其化合物的说法中正确的是
abc
abc
.
a.K
2Cr
2O
7是-种常用的强氧化剂
b.NaCrO
2溶液与AlCl
3溶液混合有沉淀生成
c.酸性K
2Cr
2O
7溶液可用于检验司机是否酒后驾车
方法2:电解法
该法用Fe做电极电解含Cr
2O
72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)
3沉淀.
(6)用Fe做电极的原因为
阳极反应为Fe-2e-=Fe2+,提供还原剂Fe2+
阳极反应为Fe-2e-=Fe2+,提供还原剂Fe2+
.
(7)在阴极附近溶液pH升高的原因是(用电极反应解释)
2H++2e-=H2↑
2H++2e-=H2↑
.溶液中同时生成的沉淀还有
Fe(OH)3
Fe(OH)3
.









 的反应条件是
的反应条件是 +CH3OH
+CH3OH +H2O
+H2O +CH3OH
+CH3OH +H2O
+H2O 、
、 、
、
 、
、 、
、
 两种不同的空间异构体.下列各物质中,能形成类似上述两种空间异构体的是( )
两种不同的空间异构体.下列各物质中,能形成类似上述两种空间异构体的是( )