下表是某些短周期元素的电负性(x)值:
| 元素符号 |
Li |
Be |
N |
O |
F |
Na |
Mg |
Al |
P |
S |
| X值 |
0.98 |
1.57 |
3.04 |
3.44 |
3.98 |
0.93 |
1.31 |
1.61 |
2.19 |
2.58 |
(1)根据表中数据归纳元素的电负性与原子吸引电子的能力的关系
元素的电负性越大,原子吸引电子的能力越强
元素的电负性越大,原子吸引电子的能力越强
.
(2)试推测,周期表所列元素中除放射性元素外,电负性最小的元素与电负性最大的元素形成的化合物的电子式为
.
(3)已知:Cl-Br+H-OH

H-Cl+HO-Br.
①若NCl
3最初水解产物是NH
3和HOCl,则x(Cl)的最小范围:
2.58~3.04
2.58~3.04
(填表中数值);
②PCl
3水解的化学反应方程式是
PCl3+3H2O=3HCl+H3PO3(或P(OH)3)
PCl3+3H2O=3HCl+H3PO3(或P(OH)3)
.
(4)一般认为:如果两个成键元素间的电负性差值大于1.7,它们之间通常形成离子键,小于1.7通常形成共价键,结合问题(3)-①,分析BeCl
2属于
共价化合物
共价化合物
.(填离子化合物或共价化合物)
请设计实验加以证明
测定熔融态的BeCl2不导电
测定熔融态的BeCl2不导电
.

 1994年度诺贝尔化学奖授予为研究臭氧作出特殊贡献的化学家.O3能吸收有害紫外线,保护人类赖以生存的空间.O3分子的结构如图,呈V型,键角116.5℃.三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键--三个O原子均等地享有这4个电子.请回答:
1994年度诺贝尔化学奖授予为研究臭氧作出特殊贡献的化学家.O3能吸收有害紫外线,保护人类赖以生存的空间.O3分子的结构如图,呈V型,键角116.5℃.三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键--三个O原子均等地享有这4个电子.请回答: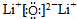
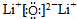





 H-Cl+HO-Br.
H-Cl+HO-Br.