
题目列表(包括答案和解析)


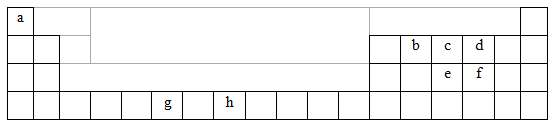
(13分)下表为周期表的一部分,表中所列的字母分别代表一种化学元素。
|
a |
|
|
|
|
|||||||||||||
|
|
|
|
|
b |
c |
d |
|
|
|||||||||
|
|
|
|
|
|
e |
f |
|
|
|||||||||
|
|
|
|
|
|
g |
|
h |
|
|
|
|
|
|
|
|
|
|
用化学用语回答下列问题:
(1)写出元素g的基态原子核外电子排布式___________________________,
h2+中未成对电子数为 。
(2)在b2a2分子中,元素b为 杂化,该分子是 分子(填“极性”或“非极性”),该分子中σ键和π键的数目比为 。
(3) bd2与bf2比较,沸点较高的是_______(填分子式),原因是 。
(4)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙正确是 。
A.h位于元素周期表中第四周期第VIII族,属于d区元素
B.e的基态原子中,3p能级为半充满,属于p区元素
C.最外层电子排布式为4s2,一定属于IIA族
D.最外层电子排布式为ns2np1,该元素可能是ⅢA族或ⅢB族
(5)科学研究表明,元素b与元素c可以形成一种超硬、耐磨、耐高温的新型无机非金属材料,其化学式为 ,其熔点比金刚石 (填“高”或“低”)。
下表为周期表的一部分,表中所列的字母分别代表一种化学元素。
| a | |||||||||||||||||
| b | c | d | |||||||||||||||
| e | f | ||||||||||||||||
| g | h | ||||||||||||||||
用化学用语回答下列问题:
(1)写出元素g的基态原子核外电子排布式____________,h2+中未成对电子数为 ![]() 。
。
(2)在b2a2分子中,元素b为 杂化,![]() 该分子是 分子(填“极性”或“非极性”),该分子中σ键和π键的数目比为 。
该分子是 分子(填“极性”或“非极性”),该分子中σ键和π键的数目比为 。
(3)bd2与bf2比较,沸点较高的是_______(填分子式),原因是 。
(4)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙正确是 。
A、h位于元素周期表中第四周期第VIII族,属于d区元素
B、e的基态原子中,3p能级为半充满,属于p区元素
C、最外层电子排布式为4s2,一定属于IIA族
D、最外层电子排布式为ns2np1,该元素可能是ⅢA族或ⅢB族
(5)科学研究表明,元素![]() b与元素c可以形成一种超硬、耐磨、耐高温的新型无机非金属材料,其化学式为 ,其熔点比金刚石 (填“高”或“低”)。
b与元素c可以形成一种超硬、耐磨、耐高温的新型无机非金属材料,其化学式为 ,其熔点比金刚石 (填“高”或“低”)。
| 品 名 | 浓缩菠萝汁 |
| 配 料 | ①浓缩菠萝汁 ②蔗糖 ③柠檬黄 ④山梨酸钾 ⑤水 |
| 果汁含量 | ≥80% |
| 生产日期 | 标于包装封口处 |
| 催化剂 |
| 高温 |
| 催化剂 |
| 高温 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com