
题目列表(包括答案和解析)
摩尔质量是指单位物质的量的物质所具有的质量。
(1)已知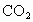 的相对分子质量为44,则
的相对分子质量为44,则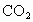 的摩尔质量为__________.
的摩尔质量为__________.
(2)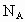 为阿伏加德罗常数值,已知ag某气体中含分子数为b,则该气体的摩尔质量为___________.
为阿伏加德罗常数值,已知ag某气体中含分子数为b,则该气体的摩尔质量为___________.
(3)已知一个铁原子的质量为bg,则铁原子摩尔质量为______.
(4)已知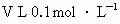 某硝酸盐溶液中含溶质mg,则该硝酸盐的摩尔质量为____________.
某硝酸盐溶液中含溶质mg,则该硝酸盐的摩尔质量为____________.
摩尔质量是指单位物质的量的物质所具有的质量。
(1)已知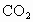 的相对分子质量为44,则
的相对分子质量为44,则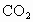 的摩尔质量为__________.
的摩尔质量为__________.
(2)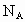 为阿伏加德罗常数值,已知ag某气体中含分子数为b,则该气体的摩尔质量为___________.
为阿伏加德罗常数值,已知ag某气体中含分子数为b,则该气体的摩尔质量为___________.
(3)已知一个铁原子的质量为bg,则铁原子摩尔质量为______.
(4)已知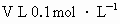 某硝酸盐溶液中含溶质mg,则该硝酸盐的摩尔质量为____________.
某硝酸盐溶液中含溶质mg,则该硝酸盐的摩尔质量为____________.
 7N2+12H2O也可处理NO2。当转移12mol电子时,消耗的NO2在标准状况下是_________L。
7N2+12H2O也可处理NO2。当转移12mol电子时,消耗的NO2在标准状况下是_________L。 2SO3(g) ΔH=-196.6 kJ/mol
2SO3(g) ΔH=-196.6 kJ/mol  2NO2(g) ΔH=-113.0 kJ/mol
2NO2(g) ΔH=-113.0 kJ/mol  SO3(g)+NO(g)的ΔH=____________kJ/mol。一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是__________。
SO3(g)+NO(g)的ΔH=____________kJ/mol。一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是__________。  CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH_______0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是__________________。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH_______0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是__________________。 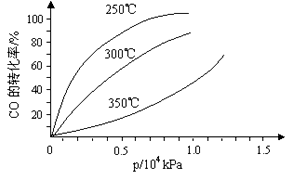
肉桂酸甲酯M,常用作调制具有草莓、葡萄、樱桃等香味的食用香精。M属于芳香化合物,苯环上只含一个直支链,能发生加聚反应和水解反应。测得M的摩尔质量为162 g·mol-1,只含碳、氢、氧三种元素,且原子个数之比为5∶5∶1。
⑴肉桂酸甲酯的结构简式是 。
⑵G为肉桂酸甲酯的一种同分异构体,其分子结构模型如右图所示(图中球与球之间连线表示单链或双键)。G的结构简式为 。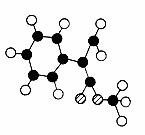
⑶以芳香烃A为原料合成G的路线如下:
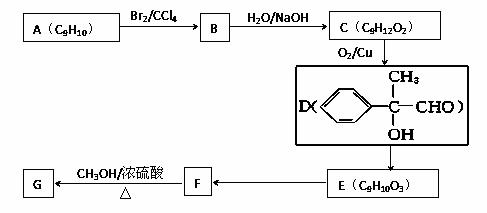
①化合物E中的含氧官能团有________(填名称)。
②E→F的反应类型是__________,F→G的化学方程式为__________________ ____。
③符合下列条件的F的同分异构体有_____种,其中能与银氨溶液反应,且1mol该有机物与析出的银的物质的量之比为1∶4的是 (写结构简式),其中核磁共振氢谱图中有6个峰,且峰面积之比为1∶1∶1∶1∶2∶2的是 (写结构简式)。
Ⅰ.分子内含苯环,且苯环上只有一个支链;不含“―O―O―”和“―C≡C―”;
Ⅱ.在催化剂作用下,1 mol该物质与足量氢气充分反应,消耗5 mol H2;
Ⅲ.它不能发生水解反应,不能发生酯化反应。
(1)如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么,ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率由大到小的顺序是____________。
(2)铁酸钠之所以能净水,除它本身具有强氧化性外,另一个原因可能是_________________。
(3)二氧化氯是一种黄绿色的有刺激性气味的气体,其熔点为-59 ℃,沸点为11.0 ℃,易溶于水,ClO2可以看作是亚氯酸和氯酸的混合酸酐,工业上用稍潮湿的KClO3和草酸在60 ℃时反应制得。某学生用如图所示的装置模拟工业制取及收集ClO2,其中A为ClO2的发生装置,B为ClO2的凝集装置,C为尾气吸收装置。

请完成下列问题:
①A部分还应添加温度控制(如水浴加热)装置,B部分还应补充什么装置?_____________
______________________________________________________________。
②C中应盛放的试剂为_____________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com