(2013?朝阳区二模)某实验小组把CO
2通入饱和Na
2CO
3溶液制取NaHCO
3,装置如图所示(气密性已检验,部分夹持装置略):
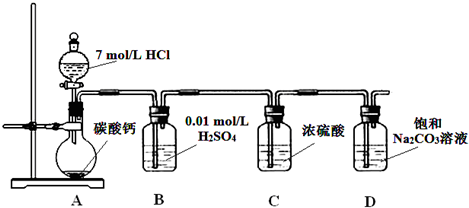
(1)D中产生NaHCO
3的化学方程式是
Na2CO3+CO2+H2O═2NaHCO3
Na2CO3+CO2+H2O═2NaHCO3
.
(2)请结合化学平衡移动原理解释B中溶液的作用
CO2在水中存在平衡:CO2+H2O?H2CO3?HCO3-+H+,有H2SO4存在时,可使上述平衡向左移动,从而减少CO2在水中的溶解,同时吸收挥发出来的HCl气体
CO2在水中存在平衡:CO2+H2O?H2CO3?HCO3-+H+,有H2SO4存在时,可使上述平衡向左移动,从而减少CO2在水中的溶解,同时吸收挥发出来的HCl气体
.
(3)当D中有大量白色固体析出时,停止实验,将固体过滤、洗涤、干燥备用.为确定固体的成分,实验小组设计方案如下(称取一定质量的固体,配成1000mL溶液作为样液,其余固体备用):
①方案1:取样液与澄清的Ca(OH)
2溶液混合,出现白色沉淀.实验小组对现象产生的原理进行分析,认为该方案不合理,理由是
Na2CO3和NaHCO3都能跟Ca(OH)2溶液发生反应生成白色沉淀,无法确定固体的成分中是否含有NaHCO3
Na2CO3和NaHCO3都能跟Ca(OH)2溶液发生反应生成白色沉淀,无法确定固体的成分中是否含有NaHCO3
.
②方案2:取样液与BaCl
2溶液混合,出现白色沉淀并有气体产生.实验小组认为固体中存在NaHCO
3,其离子方程式是
2HCO3-+Ba2+=BaCO3↓+CO2↑+H2O
2HCO3-+Ba2+=BaCO3↓+CO2↑+H2O
.该小组认为不能确定是否存在Na
2CO
3,你认为该结论是否合理?
合理
合理
.
③方案3:实验小组中甲、乙同学利用NaHCO
3的不稳定性进行如下实验:
甲同学:取样液400mL,用pH计测溶液pH,再水浴加热蒸发至200mL,接下来的操作是
冷却到室温,加水至溶液体积为400mL,再次测定pH
冷却到室温,加水至溶液体积为400mL,再次测定pH
,结果表明白色固体中存在NaHCO
3.为进一步证明白色固体是否为纯净的NaHCO
3,结合甲同学实验,还应补充的实验是
取相同质量的纯净的NaHCO3配成1000mL溶液,取400mL,重复甲的实验,进行对照
取相同质量的纯净的NaHCO3配成1000mL溶液,取400mL,重复甲的实验,进行对照
.
乙同学:利用仪器测定了固体残留率
(残留率=×100%)随温度变化的曲线,如图所示.
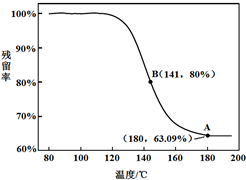
a.根据A点坐标得到的结论是
白色固体为NaHCO3
白色固体为NaHCO3
.
b.根据B点坐标,计算残留固体中n(NaHCO
3):n(Na
2CO
3)=
1.7
1.7
.
通过上述实验,该小组认为,可以向饱和Na
2CO
3溶液中通入过量CO
2制备NaHCO
3.

 某小组同学在实验室中组装如图所示装置,a为铁片,b为石墨,请回答:
某小组同学在实验室中组装如图所示装置,a为铁片,b为石墨,请回答:

 有H2SO4和HCl的混合溶液20mL,在溶液中加入0.025mol?L-1的Ba(OH)2溶液,生成的BaSO4的量和相对应的溶液的pH如图所示,求解下列问题:
有H2SO4和HCl的混合溶液20mL,在溶液中加入0.025mol?L-1的Ba(OH)2溶液,生成的BaSO4的量和相对应的溶液的pH如图所示,求解下列问题: (2010?中山模拟)如图所示,在一烧杯中盛有H2SO4溶液,同时有一表面光滑的塑料小球悬浮于溶液中央,向该烧杯中缓缓注入 Ba(OH)2溶液至恰好完全反应(设H2SO4和Ba(OH)2溶液密度相同).试回答:
(2010?中山模拟)如图所示,在一烧杯中盛有H2SO4溶液,同时有一表面光滑的塑料小球悬浮于溶液中央,向该烧杯中缓缓注入 Ba(OH)2溶液至恰好完全反应(设H2SO4和Ba(OH)2溶液密度相同).试回答: