
题目列表(包括答案和解析)
(1)能使c(OH-)减小,使c(NH+4)增大的是 。?
(2)能使c(OH-)增大,使c(NH+4)减小的是 。?
(3)能使c(OH-)和c(NH+4)都增大的是 。?
(4)能使c(OH-)和c(NH+4)都减小的是 。
(1)某过氧化钠样品已经部分变质,请你选择一种溶液 ,证明过氧化钠已经变质。
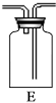
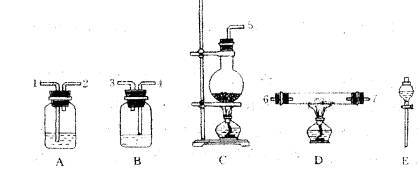
(2)某课外活动小组为了粗略测定过氧化钠的质量分数,他们称取ag样品,并设计用下图装置来测定过氧化钠的质量分数。
(A) (B) (C) (D) (E) (F)
上图中的E和F构成量气装置,用来测定O2的体积。
①写出装置B中发生反应的离子方程式:
②NaOH的作用是
③他们在读出量筒内水的体积数后,折算成标准状况下氧气的体积为VmL,则样品中过氧化钠的质量分数为
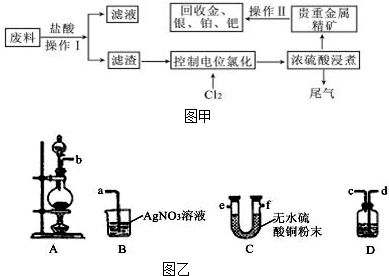
可选用的药品:MgCl2•6H2O晶体、NaCl(固)、KClO3(固)、MnO2、浓H2SO4、浓HCl、稀NaOH溶液。
仪器:见下图(装置可重复使用)。
回答下列问题:
(1)组装氯化氢气体发生器,应选用的仪器(用编号A、B…填入)是 ,有关的化学方程式是 ;
(2)按HCl气流方向,其余装置的连接顺序(用数字1、2…填入)是:( )→( )( )→( )( )→( )( );
(3)各装置中应放的药品:A B C D E ;
(4)B装置的作用是 ,B中能观察到的现象是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com