
题目列表(包括答案和解析)
(14分)食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6]•3H2O。
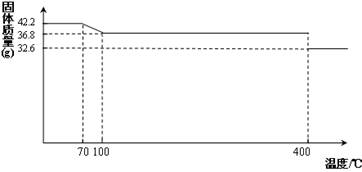
42.2g K4[Fe(CN)6] •3H2O样品受热脱水过程的热重曲线(样品质量随温度的变化曲线)如下图所示。
试回答下列问题:
(1)试确定150℃时固体物质的化学式为_______________。
(2)查阅资料知:虽然亚铁氰化钾自身毒性很低,但其水溶液与酸反应放出极毒的氰化氢(HCN)气体;亚铁氰化钾加热至一定温度时能分解产生氰化钾(KCN)。据此判断,烹饪食品时应注意的问题为___________________________________。
(3)在25℃下,将a mol•L-1的KCN(pH>7)溶液与0.01mol•L-1的盐酸等体积混合,反应平衡时,测得溶液pH=7,则KCN溶液的物质的量浓度a_______0.01mol•L-1(填“>”、“<”或“=”);用含a的代数式表示HCN的电离常数Ka=______________。
(4)在Fe2+、Fe3+的催化作用下,可实现2SO2+O2+2H2O=2H2SO4的转化。已知,含SO2的废气通入Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ = 4Fe3+ + 2H2O,则另一反应的离子方程式为 。则上述转化的重要意义在于 。
(5)已知Fe(OH)3的溶度积常数Ksp=1.1×10-36。室温时在FeCl3溶液中滴加NaOH溶液,当溶液中Fe3+沉淀完全时,控制pH应不小于 。
(提示:当某离子浓度小于10-5 mol•L-1时可以认为该离子沉淀完全了;lg1.1×10-36=-35.96)
(14分)食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6] •3H2O。
42.2g K4[Fe(CN)6] •3H2O样品受热脱水过程的热重曲线(样品质量随温度的变化曲线)如下图所示。
试回答下列问题:
(1)试确定150℃时固体物质的化学式为_______________。
(2)查阅资料知:虽然亚铁氰化钾自身毒性很低,但其水溶液与酸反应放出极毒的氰化氢(HCN)气体;亚铁氰化钾加热至一定温度时能分解产生氰化钾(KCN)。据此判断,烹饪食品时应注意的问题为___________________________________。
(3)在25℃下,将a mol•L-1的KCN(pH>7)溶液与0.01mol•L-1的盐酸等体积混合,反应平衡时,测得溶液pH=7,则KCN溶液的物质的量浓度a_______0.01mol•L-1(填“>”、“<”或“=”);用含a的代数式表示HCN的电离常数Ka=______________。
(4)在Fe2+、Fe3+的催化作用下,可实现2SO2+O2+2H2O=2H2SO4的转化。已知,含SO2的废气通入Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ = 4Fe3+ + 2H2O,则另一反应的离子方程式为 。则上述转化的重要意义在于 。
(5)已知Fe(OH)3的溶度积常数Ksp=1.1×10-36。室温时在FeCl3溶液中滴加NaOH溶液,当溶液中Fe3+沉淀完全时,控制pH应不小于 。
(提示:当某离子浓度小于10-5 mol•L-1时可以认为该离子沉淀完全了;lg1.1×10-36=-35.96)
在一定条件下,在一容积可变的密闭容器中,将SO2和O2混合发生反应:
2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-92.3KJ/mol
2SO3(g) ΔH=-92.3KJ/mol
0~4min时,容器气体压强为101KPa。反应过程中,SO2、O2、SO3的物质的量(mol)的变化如下表:
| 时间min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| n(SO2) | 2.00 | 1.92 | 1.84 | 1.76 | 1.76 | 1.64 | 1.52 | 1.40 | 1.40 | 1.40 |
| n(O2) | 1.00 | 0.96 | 0.92 | 0.88 | 0.88 | 0.82 | 0.76 | 0.70 | 0.70 | 0.70 |
| n(SO3) | 0 | 0.08 | 0.16 | 0.24 | 0.24 | 0.36 | 0.48 | 0.60 | 0.60 | 0.60 |
回答下列问题:
(1)①______________时,反应处于平衡状态。
②第5min时,从速率和转化率两个方面分析,改变的外界条件是________;平衡向_____方向移动。
③在0.1Mpa、500℃时,起始时O2和SO2的物质的量之比![]() 的值,与SO2平衡时的体积百分含量的变化曲线如图。
的值,与SO2平衡时的体积百分含量的变化曲线如图。

在图中画出在相同压强下,温度为400℃时,起始O2和SO2的物质的量之比![]() 的值,与SO2平衡时的体积百分含量的大致变化曲线。
的值,与SO2平衡时的体积百分含量的大致变化曲线。
(2)草酸(H2C2O4)是二元弱酸,KHC2O4溶液呈酸性。向10mL 0.01mol•L1的H2C2O4溶液滴加0.01mol•L1KOH溶液V(mL),回答下列问题。
①当V<10mL时,反应的离子方程式为 。
②当V=10mL时,溶液中HC2O4、C2O42、H2C2O4、H+的浓度从大到小的顺序为
。
③当V=amL时,溶液中离子浓度有如下关系:c(K+)=2c(C2O42)+c(HC2O4);
当V=bmL时,溶液中离子浓度有如下关系:c(K+)=c(C2O42)+c(HC2O4)+c(H2C2O4);则a b(填“<”,“=”或“>”)。
④当V=20mL时,再滴入NaOH溶液,则溶液中n(K+) / n(C2O42-)的值将 (填“变大”,“变小”,“不变”),原因是 。

| 熔点 | 沸点 | |
| PCl3 | -112℃ | 75℃ |
| PCl5 | 148℃ | 200℃ |
| ||
| ||



湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com