
题目列表(包括答案和解析)
A.![]() g×cm-3 B.
g×cm-3 B.![]() g×cm-3
g×cm-3
C.![]() g×cm-3
D.
g×cm-3
D.![]() g×cm-3
g×cm-3
某硫酸溶液物质的量浓度是xmol×L-1,含H2SO4的质量分数为a%,则该溶液的密度是( )
A.![]() g×cm-3 B.
g×cm-3 B.![]() g×cm-3
g×cm-3
C.![]() g×cm-3
D.
g×cm-3
D.![]() g×cm-3
g×cm-3
(1)0.1mol/L Na2CO3溶液呈 (填“酸性”、“碱性”或“中性”),其原因是 (用离子方程式表示)
(2)氢氧燃料电池是利用氢能的一种重要方式。请写出氢氧燃料电池(电解质溶液为KOH溶液)的负极的电极反应式 。
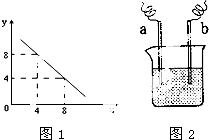
(3)某温度下的水溶液中,c(H+)=10-xmol/L,
c(OH-)=10-y mol/L。x与y的关系如右图所示:
该温度下水的离子积为 ;该温度下0.01 mol/L NaOH溶液的pH为 。
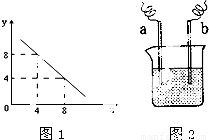
(4)如右图装置,已知两电极上发生的电极反应分别为:a极:Cu2++2e-=Cu
b极:Fe-2e-= Fe2+
该装置中原电解质溶液一定含有 (填序号)
A. Cu2+ B.Na+ C.Fe2+ D. Ag+
(5)硫酸钡在水中存在沉淀溶解平衡:BaSO4(s)Ba 2+ (aq)+ SO42-(aq) 25℃ 时,BaSO4的Ksp=1.1×l0—10,在0.1 mol·L一1硫酸溶液中,钡离子的浓度最大可达到 mol·L一1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com