
题目列表(包括答案和解析)
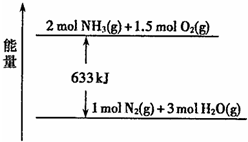 (2011?福建模拟)甲是一元强碱,其阴、阳离子所含电子总数相等.在溶液中能发生下列反应:
(2011?福建模拟)甲是一元强碱,其阴、阳离子所含电子总数相等.在溶液中能发生下列反应:| △ |
| ||
| ||
| c4(NO)×c6(H2O) |
| c4(NH3)×c5(O2) |
| c4(NO)×c6(H2O) |
| c4(NH3)×c5(O2) |
X、Y、Z是阳离子,K是阴离子,M、N是中性分子。它们具有以下结构特征和性质:①它们核外电子总数都相同;②N溶于M中,滴入酚酞,溶液变红;③Y和K都由A、B两元素组成,Y核内质子总数比K多两个;④X、N都由A、C两元素组成,X和Y核内质子总数相等;⑤Y+K=2M,X+K=M+N;⑥Z为单核离子,向含有Z的溶液中加入少量K,有白色沉淀生成,再加入过量的K,沉淀消失。以上待确定物质均由短周期元素组成。
试完成下列各题:
(1)Y的化学式为 ;M的电子式为 ;X的电子式为 ;
(2)Z与M反应的离子方程式为:
(3)核外电子数相同的B、C、Z的常见单核离子半径由大到小的顺序为:
(4)写出下列反应的离子方程式:
Y+K ;Z+N的水溶液
【化学–选修3:物质结构与性质】(15分)
X、Y、Z、W四种元素原子序数依次增大且均小于36。 Z基态原子最外层电子数是其内层电子总数的3倍,Y基态原子是同周期元素中未成对电子数最多的原子,X分别与Y、Z元素组合均可形成10电子微粒, W基态原子有10个价电子。回答下列问题(以下问题均以推知元素符号作答):
(1)若 YX3与X2Z﹑YX2-与ZX-﹑Y3-与Z2-性质相似,请写出Mg(YX2)2在一定条件下分解的化学反应方程式
⑵已知0℃时X2Z的密度为a g/cm3,其晶胞中X2Z分子的空间排列方式与金刚石晶胞类似,相似的原因是 。两个X2Z分子间的最近距离为 pm(用a和NA表示)。 已知X2Y的升华热是51 kJ/mol,除氢键外,X2Z分子间还存在范德华力(11 kJ/mol),则X2Z晶体中氢键的“键能”是 kJ/mol。
⑶ WZ是一种功能材料,已被广泛用于电池电极、催化剂、半导体、玻璃染色剂等方面。工业上常以W(YZ3)2·6X2Z和尿素[CO(NH2)2]为原料制备。
①W2+的基态核外电子排布式为 ,其核外电子有 种运动状态。
②尿素分子中碳原子的杂化方式为 ,1 mol尿素分子中含有的σ键数为 。
③YZ3-的空间构型 。
④WZ晶体的结构与NaCl相同,但天然的和绝大部分人工制备的晶体都存在各种缺陷,例如在某种WZ晶体中就存在如图所示的缺陷:一个W2+空缺,另有两个W2+被两个W3+所取代。其结果晶体仍呈电中性,但化合物中W和Z的比值却发生了变化。经测定某样品中W3+与W2+的离子数之比为6∶91。若该晶体的化学式为WxZ,则x= 。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com