
题目列表(包括答案和解析)
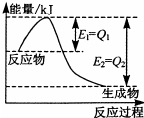 运用化学反应原理研究氮、硫、氯等单质及其化合物的反应有重要的意义.
运用化学反应原理研究氮、硫、氯等单质及其化合物的反应有重要的意义.| 化学式 | Ksp | 化学式 | Ksp |
| AgBr | 5.0×10-13 | Ag2CO3 | 8.1×10-12 |
| Ag3PO4 | 1.4×10-16 | CaCO3 | 2.8×10-9 |
| AgOH | 2.0×10-8 | Ca3(PO4)2 | 2.0×10-29 |
A.24.1% B.25.9% C.40.3% D.48.1%
现有KCl和KBr的混合物3.87 g,将混合物全部溶于水,并加入过量的AgNO3溶液,充分反应后产生6.63 g沉淀物,则原混合物中钾元素的质量分数为( )
A.24.1% B.25.9% C.40.3% D.48.1%
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com