
题目列表(包括答案和解析)
实验室制备溴乙烷(C2H5Br)的装置和步骤如图:(已知溴乙烷的沸点38.4℃)
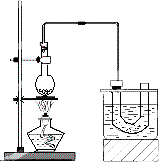
①检查装置的气密性,向装置图所示的U形管和大烧杯中加入冰水;
②在圆底烧瓶中加入10 mL 95%乙醇、28 mL 80%浓硫酸,然后加入研细的13 g溴化钠和几粒碎瓷片;
③小心加热,使其充分反应.
回答下列问题:
(1)该实验制取溴乙烷的化学方程式为:________.
(2)反应时若温度过高,可看到有红棕色气体产生,该气体分子式为________,同时还生成另一种无色气体.
(3)U型管内可观察到的现象是________.
(4)反应结束后,U形管中粗制的C2H5Br呈棕黄色.为了除去粗产品中的杂质,可选择下列试剂中的________(填字母)
A.NaOH溶液
B.H2O
C.Na2SO3溶液
D.CCl4
所需的主要玻璃仪器是________(填仪器名称).要进一步制得纯净的C2H5Br,可用水洗,然后加入无水CaCl2,再进行________(填操作名称).
(5)下列几项实验步骤,可用于检验溴乙烷中溴元素,其正确的操作顺序是:取少量溴乙烷,然后________(填代号).
①加热;
②加入AgNO3溶液;
③加入稀HNO3酸化;
④加入NaOH溶液;
⑤冷却
(6)
溴乙烷(C2H5Br)多一个碳的同系物所有可能的物质在氢氧化钠的醇溶液中能发生反应,写出该反应的化学方程式________,_________.实验室用如图所示的装置制取溴乙烷.在试管Ⅰ中依次加入2 mL蒸馏水、4 mL浓硫酸、2 mL 95%的乙醇和3 g溴化钠粉末,在试管Ⅱ中注入蒸馏水,在烧杯中注入自来水.加热试管I至微沸状态数分钟后,冷却.
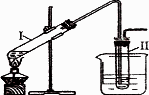
试回答下列问题:
(1)试管Ⅰ中浓硫酸与溴化钠加热反应生成氢溴酸,写出氢溴酸与乙醇在加热时反应的化学方程式________.
(2)试管Ⅰ中加入2 mL蒸馏水的目的是________.
(3)试管Ⅰ中反应除了生成溴乙烷,还可能生成的有机物有________、________(任写两种结构简式).
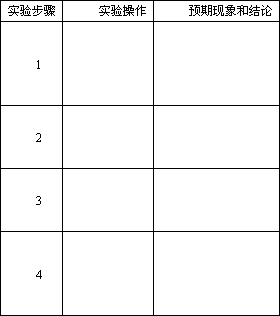
(4)设计实验证明试管Ⅱ收集的溴乙烷中含有溴元素,完成以下实验报告:
(5)设计实验方案,检验溴乙烷与NaOH乙醇溶液发生消去反应后生成的气体X中是否含乙烯.请在下面方框中画出实验装置图,并注明所用试剂的名称

实验室制备溴乙烷(C2H5Br)的原理为C2H5OH+NaBr+H2SO4![]() NaHSO4+C2H5Br+H2O,装置如图(已知溴乙烷的沸点38.4℃)和步骤如下:
NaHSO4+C2H5Br+H2O,装置如图(已知溴乙烷的沸点38.4℃)和步骤如下:
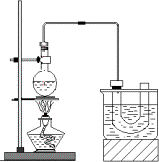
①检查装置的气密性,向装置图所示的U形管和大烧杯中加入冰水;②在圆底烧瓶中加入研细的13 g溴化钠和几粒碎瓷片,然后加入10 mL 95%乙醇、28 mL 78%浓硫酸;③小心加热,使其充分反应.
回答下列问题:
(1)反应时若温度过高,可看到有红棕色气体产生,该气体分子式为________
(2)为了更好的控制反应温度,除用图示的小火加热,更好的加热方式是________.
(3)U型管内可观察到的现象是________.
(4)反应结束后,U形管中粗制的C2H5Br呈棕黄色.为了除去粗产品中的杂质,可选择下列试剂中的________(填序号).
A.NaOH溶液 B.H2O C.Na2SO3溶液 D.CCl4
所需的主要玻璃仪器是________(填仪器名称).要进一步制得纯净的C2H5Br,可用水洗、分液,然后向油层中加入无水CaCl2,再进行________(填操作名称).
(5)下列几项实验步骤,可用于检验溴乙烷中溴元素,其正确的操作顺序是:取少量溴乙烷,然后________(填代号).
①加热;②加入AgNO3溶液;③加入稀HNO3酸化;④加入NaOH溶液;⑤冷却
已知:①溴乙烷的沸点38.4℃
②NaBr+H2SO4(浓)![]() NaHSO4+HBr↑
NaHSO4+HBr↑
③2HBr+H2SO4(浓)![]() Br2+SO2↑+2H2O
Br2+SO2↑+2H2O
实验室制备溴乙烷(C2H5Br)的装置如图,步骤如下:

①检查装置的气密性,向装置图所示的U形管和大烧杯中加入冰水;
②在圆底烧瓶中加入10 mL 95%乙醇、28 mL 78%浓硫酸,然后加入研细的13 g溴化钠和几粒碎瓷片;
③小心加热,使其充分反应.
回答下列问题:
(1)实验用乙醇、浓硫酸、溴化钠制取溴乙烷的总的化学方程式为:________.
(2)反应时若温度过高,可看到有红棕色气体产生,该气体化学式为:________.
(3)为了更好的控制温度,除用图示的小火加热外,更好的加热方式为________.
(4)①反应结束后,U形管内粗制的C2H5Br呈棕黄色.为了除去粗产品中的杂质,可以选择下列试剂中的________(填字母),所需的主要玻璃仪器为________.
A.NaOH溶液
B.Na2SO3溶液
C.CCl4
②要进一步制得纯净的C2H5Br,可用水洗,然后________(填操作名称),再加入无水CaCl2,最后进行________(填操作名称).
(5)下列几项实验步骤,可用于检验溴乙烷中溴元素,其正确的操作顺序是:取少量溴乙烷,然后________(填序号).
①加热;②加入AgNO3溶液;③加入稀HNO3酸化;④加入NaOH溶液;⑤冷却
(1)反应原理:C2H5OH+NaBr+H2SO4![]() NaHSO4+C2H5Br+H2O
NaHSO4+C2H5Br+H2O
(2)主要装置见下图
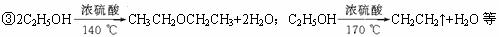
(3)操作步骤
①在100 mL圆底烧瓶中加入10 mL 95%乙醇、28 mL 78%硫酸,然后加入研细的13 g溴化钠。②加入几粒碎瓷片,小心摇动烧瓶使其均匀。将烧瓶与直形冷凝管相连,冷凝管下端连接接受器。③小心加热,使其充分反应,再进行蒸馏,直到无溴乙烷流出为止。④再将锥形瓶中液体冷却后倒入亚硫酸钠溶液中洗涤分液。
试回答下列问题:
①本实验用的是78%的硫酸,为何不用浓硫酸?________________________________。
②亚硫酸钠溶液的作用是____________________________________________________。
③该实验中会产生许多生成有机物的副反应,写出化学方程式:________________________________(举一例)。
④本次实验只收集到5 mL溴乙烷,比理想产量约10 mL少,原因是溴乙烷易挥发的缘故,为了减少其损失,你认为可采取什么措施?________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com