
题目列表(包括答案和解析)
| 实验操作 | 预期现象与结论 |
| 步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取1mol/L BaCl2溶液向小烧杯滴加直至过量. | 若出现白色浑浊,则溶液中存在SO32-或 SO42-. |
| 步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体______ ______. | ______ ______ |
| 步骤3:______ ______. | ______ ______ |
请回答下列问题:
(1)HgS与O2的反应中,氧化剂是____________,每生成1 mol Hg转移电子的物质的量为____________ mol。
(2)电解某汞的硝酸盐溶液,当阴极消耗a mol金属阳离子时,可获得
(3)随着冶炼、电镀等工业生产的不断发展,所需汞及其化合物的用量也日趋增多,随之排放出来的含汞的废水也愈加严重,现已成为世界上危害较大的工业废水之一。以下处理含汞(Hg2+)废水的方法中最简单实用的是____________(填序号)。
A.向含Hg2+的废水中加入Na2S等可溶性硫化物
B.加入金属还原剂
C.电解法
某化学兴趣小组在学习“硫的化合物的某些性质”中,进行了如下实验:
【实验一】探究SO2的性质,
按下图所示装置进行实验。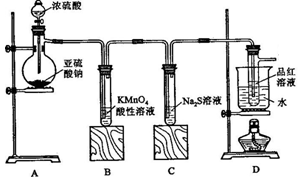
请回答下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是 ,其中发生反应的化学方程式为 ;
(2)实验过程中,装置B、C中发生的现象分别是 、 ,这些现象分别说明SO2具有的性质是 和 ;装置B中发生反应的离子方程式为 ;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象
______________________________________________;
(4)该装置有一明显缺陷,请指明_______________________,并在框图内画出补充装置(注明药品)。
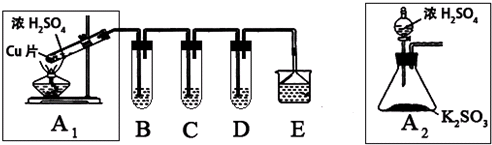
【实验二】验证足量锌与浓硫酸反应产生的气体成分是二氧化硫和氢气。按下图装置进行实验(锌与浓硫酸共热时产生的气体为X,且该装置略去)。试回答:
(5)A中加入的试剂可能是____________,作用是_______________;
B中加入的试剂可能是____________,作用是_______________;
E中加入的试剂可能是____________,作用是_______________。
(6)可以证明气体X中含有氢气的实验现象是:C中:____________,D中:__________;
铁及其化合物在生活、生产中有着广泛的应用。
Ⅰ.铁触媒(+2价铁和+3价铁组成的氧化物)是工业合成氨的催化剂。某学习小组用下列流程测定铁触媒的含铁量。根据题意回答相关问题:
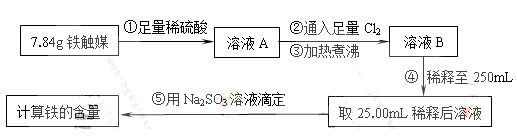
(1)步骤①中需用1.50 mol·L-1的硫酸100mL,若用18.4mol·L-1的浓硫酸来配制,则需要用量筒量取浓硫酸 mL
(2)步骤②通入Cl2的目的是 (用离子方程式表示)
(3)步骤④后需用 (填仪器名称)取25.00mL稀释后溶液。
(4)步骤⑤消耗0.10mol·L-1的Na2SO3溶液25.00mL,则铁触媒中铁的质量分数为 。
Ⅱ.目前的研究表明,铁的某些含氧酸盐可用于工业废水、废气的处理。
(1)用K2FeO4处理中性废水时与水反应生成氢氧化铁胶体,并放出无色无味的气体和其它物质,写出反应的离子反应方程式 ,处理废水时既利用K2FeO4强氧化性,又利用生成氢氧化铁胶体的 作用。
(2)MFe2O4可以与氢气反应制备新型纳米材料氧缺位铁酸盐MFe2Ox (3<x<4),其中M表示+2价的金属元素,常温下,MFe2Ox能使工业废气中的SO2转化为S,达到回收硫、净化空气目的,转化过程表示如下:
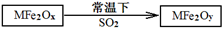
则可以判断x y,氧化性:MFe2Oy SO2(填“>”、“<”或“=”)
某化学兴趣小组的同学为进行物质性质的探究,用维持烧瓶内压强与分液漏斗内压强相等,使液体能顺利滴下
下图所示装置进行实验。请回答下列问题:(加热及固定装置已略去)

(1)装置A中反应的化学方程式为
(2)装置C 中的试剂是 ( 填序号).
A.氢氧化钠溶液 B. 酸性高锰酸钾溶液 C.亚硫酸氢钠溶液
发生反应的离子方程式为 ,其说明了SO2具有 ,该实验操作的名称是 。
(3)在上述实验中,能说明碳的非金属性比硅强的实验现象是
(4)B中的溶液无明显现象,当滴加氯水时有白色沉淀,写出SO2表现还原性并生成白色沉淀的总离子方程式为
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com