
题目列表(包括答案和解析)
(1)SiF4(正四面体形)
(2)BCl3(平面三角形)
(3)NF3(三角锥形,键角为102°)
下列分子中所有的原子都满足最外层为8电子结构的是( )
A.BCl3 B.COCl2 C.SF6 D.SiH4
按要求完成下列问题。
(1)写出Mg2+的电子排布式 。
(2)依次指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:________、________、________。
(3)判断BCl3分子的空间构型、中心原子成键时采取的杂化轨道类型及分子中共价键的键角:________、________、________。
(4)下列分子中若有手性分子,请用“*”标出其手性碳原子。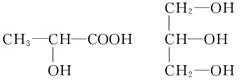
A.PH3 B.SiH
A.H2O分子(角形:![]() ) B.CO2分子(直线型:O=C=O)
) B.CO2分子(直线型:O=C=O)
C.BCl3分子(平面三角形) D.NH3分子(三角锥形)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com