
题目列表(包括答案和解析)
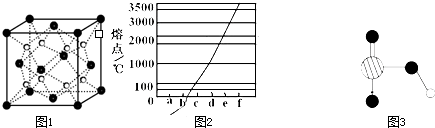
现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期。B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子。请回答下列问题:
(1)用元素符号表示B、C、D三种元素的第一电离能由低到高的顺序?????? 。
(2)下列说法错误的是??????? 。
A.二氧化硅的相对分子质量比二氧化碳大,所以沸点:SiO2>CO2
B.电负性顺序:C<N<O<F
C.N2与CO为等电子体,化学性质相似
D.由于水分子间存在氢键,所以稳定性:H2O>H2S
(3)E元素的+2价氧化物的熔点比+3价氧化物???????? (高或低),
原因是?????????? 。
(4)B单质的一种同素异形体的晶胞如图所示,若晶体的密度为ρg/cm3,阿伏加德罗常数的值为NA,则晶体中最近的两个原子之间的距离为??????? cm。

(5)F离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点。
①F原子的外围电子排布式为________ __。向F的硫酸盐溶液中通入过量C与A形成的气体N,可生成[F(N)4]2+,该离子的结构式为??????? (用元素符号表示)。
②某化合物与F(Ⅰ)(Ⅰ表示化合价为+1)结合形成图1所示的离子:该离子中碳原子的杂化方式有?????? 。

[化学—物质结构与性质]
(1)依据第2周期元素第一电离能的变化规律,参照下图B、F元素的位置,用小黑点标出C、N、O三种元素的相对位置。

(2)NF3可由NH3和F2在Cu催化剂存在下反应直接得到:4NH3+3F2 NF3+3NH4F
NF3+3NH4F
①上述化学方程式中的5种物质所属的晶体类型有_________(填序号)。
a.离子晶体 b.分子晶体 c.原子晶体 d.金属晶体
②基态铜原子的核外电子排布式为________。
(3)BF3与一定量水形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:

①晶体Q中各种微粒间的作用力不涉及___________(填序号)。
a.离子键 b.共价键 c.配位键 d.金属键 e.氢键 f.范德华力
②R中阳离子的空间构型为_______,阴离子的中心原子轨道采用_______杂化。
(4)已知苯酚( )具有弱酸性,其Ka=1.1 ×10-10;水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1 ×10-10;水杨酸第一级电离形成的离子 能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)_______Ka(苯酚)(填“>”或“<”),其原因是__________。
能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)_______Ka(苯酚)(填“>”或“<”),其原因是__________。

 NF3+3NH4F
NF3+3NH4F
 )具有弱酸性,其Ka=1.1 ×10-10;水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1 ×10-10;水杨酸第一级电离形成的离子 能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)_______Ka(苯酚)(填“>”或“<”),其原因是__________。
能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)_______Ka(苯酚)(填“>”或“<”),其原因是__________。(12分)【化学——物质结构与性质】
(1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)和Fe(CO)x等。
①基态Fe3+的M层电子排布式为 ;
②尿素(H2NCONH2)分子中C原子的杂化方式是 ;
③配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x= 。
Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于 (填晶体类型)。
(2)下列说法正确的是 (填字母序号)。
| A.第一电离能大小:S>P>Si |
| B.电负性顺序:C<N<O<F |
| C.因为晶格能CaO比KCl高,所以KCl的熔点比CaO熔点低 |
| D.分子晶体中,共价键键能越大,该分子晶体的熔沸点越高 |
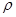 g·cm-3,阿伏加德罗常数为NA,求晶胞边长a= cm。(用含
g·cm-3,阿伏加德罗常数为NA,求晶胞边长a= cm。(用含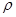 、NA的计算式表示)
、NA的计算式表示)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com