
题目列表(包括答案和解析)
太湖、巢湖、滇池是我国重点治理的三大湖,三大湖受到严重的富营养化污染,藻类疯狂繁殖,破坏了生态平衡,影响了人民的健康,必须迅速进行治理。请回答:
(1)藻类的狂长,说明水中哪些元素超标? 这些元素从哪里引入的?
(2)您认为引起藻类大量繁殖最主要的是哪一种元素? 以什么形态出现? 请你设计一个测定此元素的方法。
(3)水质污染程度的重要标志之一为BOD(生物化学耗氧量),它是指由于水中微生物的繁殖或呼吸作用,或水中有机物分解时所消耗的溶解氧的量,单位为mgO2/L。现有巢湖沿岸某电镀厂,不遵守环境法规,每周向湖中排放一次含氰废水,使近岸湖水含CN-的浓度为7.5×10-5mol/L,CN-与O2作用生成CO2、N2等。试问此电镀厂每排放一次废水将使近岸湖水的BOD增大多少?
(4)水质污染程度的另一重要指标为COD(化学耗氧量),它是指水中还原性物质(有机的和无机的),在规定条件下被氧化时,1L水样所消耗的氧的毫克数。测定COD通常有KMnO4法、K2Cr2C7法等。酸性KMnO4法:KMnO4在酸性溶液中经沸水浴加热,将发生:
2KMnO4+3H2SO4==K2SO4+2MnSO4+3H2O+5[O]。
①若为0.01000mol/L KMnO4溶液,则1.00mL相当于 mgO2;
②若巢湖水样100mL,加入1:2 H2SO410mL,AgSO41g,混匀后,又加10mL 0.01000mol/L KMnO4溶液,在沸水中加热30min,取出加入10mL 0.02500mol/L Na2C2O4溶液,立即用0.01000mol/L KMnO4滴至微红色在15秒内不变色为终点,耗KMnO4液7.00mL,求巢湖水样的COD为多少?
硫酸和硝酸是中学阶段常见的强酸。根据二者与金属的反应情况,回答下列问题:
(1)①在100mL 18mol·L-1的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是 。
A.33.6L B.22.4L C.20.16L D.6.72L
②若向上述反应①的体系中再加入硝酸钠,有什么现象出现?用必要的文字和离子
方程式加以说明 。
(2)若将过量铜粉与一定量浓硝酸反应,当反应完全停止时,共收集气体1.12L(标准状况),则该气体的成分是 ,反应中所消耗的硝酸的物质的量可能为下列数据中的 。
A.0.1mol B.0.15mol C.0.2mol D.0.25mol
主要现象 | 有关化学方程式 |
金属钠表面变暗 |
|
过些时候有液滴出现 |
|
再过些时候出现白色晶体 |
|
最后变成白色粉末 |
|
(2)一小块钠在空气中久置后,质量变为原来的62/23倍,则久置后的成分是( )
A.Na2CO3 B.Na2O2 C.NaOH D.Na2CO3·H2O
(3)钠的用途很广,其中钠钾合金可作原子反应堆的导热剂,简述其原理。
(12分)制备溴苯的实验装置如图所示,回答下列问题: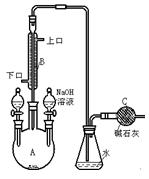
(1)装在左侧分液漏斗中的药品是 。
(2)反应方程式 。
(3)将左侧分液漏斗的旋纽打开后,在A中可观察到的现象是 。
(4)冷凝管B有上、下两口,冷却水应从 口进入。
(5)右侧分液漏斗中的物质在什么时候加入A中? 。其作用是 。
(6)要证明该反应是取代反应,最方便的实验方法是  。
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com