
题目列表(包括答案和解析)
 (2013?盐城一模)[物质结构与性质]
(2013?盐城一模)[物质结构与性质]| H | - 4 |
| 储氢 |
| 输氢 |
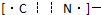
| 52 |
| a.NA |
| 52 |
| a.NA |
2- 2 |
2+ 2 |
2+ 2 |
2+ 2 |
碳的化合物在工农业生产和生活中有广泛的应用。
已知CaC2与水反应生成乙炔。请回答下列问题:
①实验室制乙炔的反应方程式为 ;
②CaC2中C22—与O 与互为等电子体,O22+的电子式可表示为 ;
与互为等电子体,O22+的电子式可表示为 ;
1 mol O22+中含有的π键数目为 (阿伏加德罗常数的值用NA表示);
③乙炔与氢氰酸反应可得丙烯腈(H2C=CH—C≡N)。丙烯腈分子中碳原子杂化轨道类型是 ,构成丙烯腈的元素中电负性最小的是 (填元素符号,下同),第一电离能最大的是 。丙烯腈分子中处于同一直线上的原子最多为 个,处于同一平面的原子为 个。
C、N、Si、Fe等元素及其化合物有重要的应用。
(1)上述四种元素的原子中,未成对电子数最多的元素是_________________。
(2)C元素是形成有机物的主要元素,下列分子中含有sp和sp3杂化方式的是__________(填写序号)。

(3)继C60之后,科学家又合成了Si60、N60。C、Si、N原子电负性由大到小的顺序是____________(用元素符号表示)。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为____________。
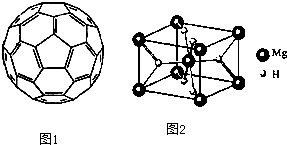
(4)一定条件下,C元素可形成多种晶体。图1是其中某种晶体的一个晶胞,该晶胞中含有___________个C原子。

(5)图2为金属铁某种晶体的晶胞结构,已知该晶体的密度为a g/cm3 为阿伏加德罗常数的值,则该晶胞的体积为_________cm3.
碳的化合物在工农业生产和生活中有广泛的应用。
已知CaC2与水反应生成乙炔。请回答下列问题:
①实验室制乙炔的反应方程式为 ;
②CaC2中C22—与O 与互为等电子体,O22+的电子式可表示为 ;
与互为等电子体,O22+的电子式可表示为 ;
1 mol O22+中含有的π键数目为 (阿伏加德罗常数的值用NA表示);
③乙炔与氢氰酸反应可得丙烯腈(H2C=CH—C≡N)。丙烯腈分子中碳原子杂化轨道类型是 ,构成丙烯腈的元素中电负性最小的是 (填元素符号,下同),第一电离能最大的是 。丙烯腈分子中处于同一直线上的原子最多为 个,处于同一平面的原子为 个。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com