(2013?德州二模)化学反应原理在工业生产中具有十分重要的意义.
(1)合成氨用的氢气有多种制取方法:请你写出用C制备水煤气的化学反应方程式
.还可以由天然气或重油制取氢气:CH
4+H
2O(g)
CO+3H
2;比较以上两种方法转移6mol电子时,C和CH
4的质量之比是
9:4
9:4
.
(2)工业生产可以用NH
3(g)与CO
2(g)经过两步反应生成尿素,两步反应的能量变化示意图如下:
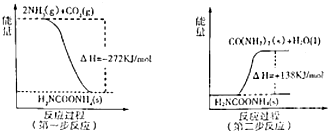
则NH
3(g)与CO
2(g)反应生成尿素的热化学方程式为
2NH3(g)+CO2(g)?H2O(l)+H2NCONH2(s)△H=-134kJ?mol-1
2NH3(g)+CO2(g)?H2O(l)+H2NCONH2(s)△H=-134kJ?mol-1
.
(3)已知反应Fe(s)+CO
2(g)?FeO(s)+CO(g)△H=αkJ?mol
-1.测得在不同温度下,该反应的平衡常数K随温度的变化如下:
| 温度(℃) |
500 |
700 |
900 |
| K |
1.00 |
1.47 |
2.40 |
①该反应的化学平衡常数表达式K=
,a
>
>
0(填“>”、“<”或“:”).在500℃2L密闭容器中进行反应,Fe和CO
2的起始量均为4mol,则5min后达到平街时CO
2的转化率为
50%
50%
,生成CO的平均速率v(CO)为
0.2mol/(Lmin)
0.2mol/(Lmin)
.
②700℃反应达到平衡后,要使该平衡向右移动,其他条件不变时,可以采取的措施有
C
C
(填字母).
A.缩小反应器容积 B.增加Fe的物质的量 C.升高温度到900℃D.使用合适的催化剂.




 (1)甲烷是一种高效清洁的新能源,0.25mol甲烷完全燃烧生成液态水时,放出222.5kJ热量,则甲烷燃烧热的热化学方为
(1)甲烷是一种高效清洁的新能源,0.25mol甲烷完全燃烧生成液态水时,放出222.5kJ热量,则甲烷燃烧热的热化学方为