
题目列表(包括答案和解析)
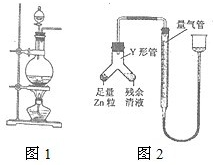 实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如图1所示).
实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如图1所示).| 甲 | 乙 | |
| A | 稀硫酸和铜 | 浓氨水和SO2 |
| B | 浓盐酸和MnO2 | BaCl2溶液和SO2 |
| C | 冷的浓硝酸和铝 | NaOH溶液和Cl2 |
| D | 浓硫酸和蔗糖(滴有几滴水) | 水和氨气 |
| A、A | B、B | C、C | D、D |
| A、NaCN和AgCN都易溶于水 | B、HCl和HCN都易形成白雾? | C、MnO2可与HCN反应生成(CN)2 | D、(CN)2和NaOH溶液反应生成NaCN、NaCNO和H2O |
A、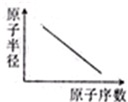 表示IA族元素原子半径的变化规律 | B、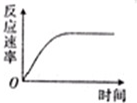 表示MnO2和热的浓盐酸反应时,反应速率随时间的变化 | C、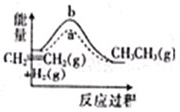 a、b曲线分别表示反应:CH2 CH2(g)+H2(g)→CH3CH3(g)△H<O在使用和未使用催化剂时,反应过程中的能量变化 | D、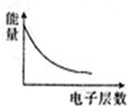 表示核外电子能量与电子层数的关系 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com