
题目列表(包括答案和解析)
(14分)实验室需要0.1 mol·L-1NaOH溶液450 moL和0.5 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
⑴ 如图所示的仪器中配制溶液肯定不需要的是 (填序号);配制上述溶液还需用到的玻璃仪器是 (填仪器名称)。
⑵ 下列操作中,容量瓶所不具备的功能有 (填序号)。
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.用来加热溶解固体溶质
⑶ 请计算需用托盘天平称取固体NaOH的质量为 g。某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图.由图中可以看出,烧杯的实际质量为 g。
⑷ 根据以上计算得知,所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为 mL(计算结果保留一位小数)。配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是 。
实验室需要0.1 mol/L NaOH溶液450 mL和0.5 mol/L硫酸溶液450 mL.根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是 (填序号),仪器C的名称是 ,
本实验所需玻璃仪器E规格为 mL。
(2)下列操作中,容量瓶所不具备的功能有 (填序号)。
A.配制一定体积准确浓度的标准溶液 B.长期贮存溶液
C.用来加热溶解固体溶质 D. 量取一定体积的液体
(3)在配制NaOH溶液实验中其他操作均正确。若定容时仰视刻度线,则所配溶液浓度 0.1 mol/L(填“大于”“等于”或“小于”,下同)。若NaOH溶液未冷却即转移至容量瓶定容则所配溶液浓度
0.1 mol/L。
(4)根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为 mL(计算结果保留一位小数)。如果实验室有10 mL、25mL、50 mL量筒,应选用 mL规格的量筒最好。
(14分)实验室需要0.1 mol·L-1NaOH溶液450 moL和0.5 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
⑴ 如图所示的仪器中配制溶液肯定不需要的是 (填序号);配制上述溶液还需用到的玻璃仪器是 (填仪器名称)。
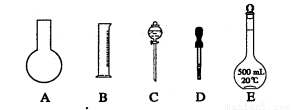
⑵ 下列操作中,容量瓶所不具备的功能有 (填序号)。
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.用来加热溶解固体溶质
⑶ 请计算需用托盘天平称取固体NaOH的质量为 g。某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图.由图中可以看出,烧杯的实际质量为 g。
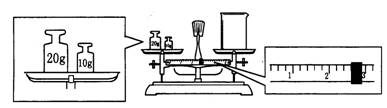
⑷ 根据以上计算得知,所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为 mL(计算结果保留一位小数)。配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是 。
实验室需要0.1 mol/L NaOH溶液450 mL和0.5 mol/L硫酸溶液450 mL.根据这两种溶液的配制情况回答下列问题:

(1)如图所示的仪器中配制溶液肯定不需要的是 (填序号),仪器C的名称是 ,
本实验所需玻璃仪器E规格为 mL。
(2)下列操作中,容量瓶所不具备的功能有 (填序号)。
A.配制一定体积准确浓度的标准溶液 B.长期贮存溶液
C.用来加热溶解固体溶质 D. 量取一定体积的液体
(3)在配制NaOH溶液实验中其他操作均正确。若定容时仰视刻度线,则所配溶液浓度 0.1 mol/L(填“大于”“等于”或“小于”,下同)。若NaOH溶液未冷却即转移至容量瓶定容则所配溶液浓度
0.1 mol/L。
(4)根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为 mL(计算结果保留一位小数)。如果实验室有10 mL、25mL、50 mL量筒,应选用 mL规格的量筒最好。
| |||||||||||||||||||||||||||||||||||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com