
题目列表(包括答案和解析)
(1)(6分)在Cu + 2H2SO4(浓)![]() CuSO4 + SO2↑+ 2H2O反应中,氧化剂是____,还原剂是___,被氧化的元素是____,被还原的元素是_____,当有0.1mol电子发生转移时,生成的SO2在标准状况下的体积______L,消耗的铜的质量为______g。
CuSO4 + SO2↑+ 2H2O反应中,氧化剂是____,还原剂是___,被氧化的元素是____,被还原的元素是_____,当有0.1mol电子发生转移时,生成的SO2在标准状况下的体积______L,消耗的铜的质量为______g。
(2))(6分)现有10克由2 H和16O组成的水分子,其中含中子的物质的量为______mol , 电子个数为______。在一定温度和压强下,10体积气体A2跟30体积的气体B2化合生成20体积某气体C,则该气体C的化学式为(用A、B表示)__________。
Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(1)该反应中H2SO4既起了氧化剂的作用,又起了________作用。
(2)若生成32gSO2被还原的H2SO4是________g。
(3)若用该方法制取定量的CuSO4时,有两个缺点:一是________,二是________________。解决这两个缺点的方法是:先将Cu与________反应,再与________反应。
根据化学方程式回答下列问题
Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(1)该反应中H2SO4既起了氧化剂的作用,又起了________作用。
(2)若生成32gSO2被还原的H2SO4是________g。
(3)若用该方法制取定量的CuSO4时,有两个缺点:一是________,二是________________。解决这两个缺点的方法是:先将Cu与________反应,再与________反应。
已知下列两个反应①Fe+H2SO4(稀)=FeSO4+H2↑
②Cu+2H2SO4(浓)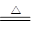 CuSO4+SO2↑+2H2O。试回答下列问题:
CuSO4+SO2↑+2H2O。试回答下列问题:
(1)反应①中 元素被还原,反应②中 元素被还原.
(2)当反应①生成2gH2时,消耗H2SO4的物质的量是 。
(3)反应②若有1mol H2SO4作氧化剂时,转移电子的物质的量为 ,若有4mol H2SO4参加反应时,被还原元素的质量是 g。
已知下列两个反应①Fe+H2SO4(稀)=FeSO4+H2↑
②Cu+2H2SO4(浓)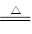 CuSO4+SO2↑+2H2O。试回答下列问题:
CuSO4+SO2↑+2H2O。试回答下列问题:
(1)反应①中 元素被还原,反应②中 元素被还原.
(2)当反应①生成2gH2时,消耗H2SO4的物质的量是 。
(3)反应②若有1mol H2SO4作氧化剂时,转移电子的物质的量为 ,若有4mol H2SO4参加反应时,被还原元素的质量是 g。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com