原子序数由小到大排列的四种短周期元素X、Y、Z、W,它们的原子序数之和为26,在同周期中W的原子半径最大,W和Z可形成W
2Z和W
2Z
2;X、Y、Z三种元素中的任意两种之间可以组成甲、乙、丙…等许多种化合物.
(1)这四种元素的符号分别是X
H
H
、Y
C
C
、Z
O
O
、W
Na
Na
,用电子式表示W
2Z形成过程
.
(2)甲是一种气体,通入紫色石蕊试液中,溶液变红.甲的分子式为
CO2
CO2
,写出甲与W
2Z
2反应的化学方程式
2CO2+2Na2O2=2Na2CO3+O2
2CO2+2Na2O2=2Na2CO3+O2
.
(3)乙是一种化石燃料,其分子呈正四面体构型,写出它的电子式
;560mL(标准状况下)乙完全燃烧生成液态水,产生热量22.25kJ.写出乙燃烧热的热化学方程式为
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H═-890kJ?mol-1
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H═-890kJ?mol-1
.
(4)丙是X和Z按原子个数比1:1组成的化合物.已知丙的溶液能使酸性高锰酸钾溶液褪色.将含有0.5mol丙的溶液滴加到100mL 2mol?L
-1酸性高锰酸钾溶液中,溶液紫色恰好褪色.该反应的离子方程式为:
2MnO4-+5H2O2+6H+=2Mn2++8H2O+502 ↑
2MnO4-+5H2O2+6H+=2Mn2++8H2O+502 ↑
.

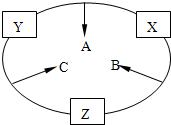 原子序数之和为16的三种短周期元素的单质X、Y、Z,常温常压下均为无色气体,在适当条件下X、Y、Z之间可以发生如右图所示的变化.
原子序数之和为16的三种短周期元素的单质X、Y、Z,常温常压下均为无色气体,在适当条件下X、Y、Z之间可以发生如右图所示的变化.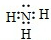
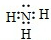
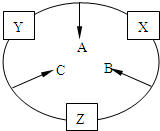 原子序数之和为16的三种短周期元素的单质X、Y、Z,常温常压下均为无色气体,在适当条件下X、Y、Z之间可以发生如右图所示的变化.已知B分子组成中Z原子
原子序数之和为16的三种短周期元素的单质X、Y、Z,常温常压下均为无色气体,在适当条件下X、Y、Z之间可以发生如右图所示的变化.已知B分子组成中Z原子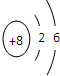
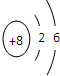
 NH4++OH-
NH4++OH- NH4++OH-
NH4++OH-


