
题目列表(包括答案和解析)
R为元素周期表中不超过20号元素中的金属元素,取16.15 gR的氯化物和溴化物的混合物,使之与足量的AgNO3溶液反应,共生成32.30 g卤化银沉淀.试通过计算确定R元素的名称.
钠是活泼的碱金属元素,钠及其化合物在生产和生活中有广泛的应用.
完成下列计算:
1.叠氮化钠(NaN3)受撞击完全分解产生钠和氮气,故可应用于汽车安全气囊.若产生40.32 L(标准状况下)氮气,至少需要叠氮化钠________g.
2.钠-钾合金可在核反应堆中用作热交换液.5.05 g钠-钾合金溶于200 mL水生成0.075 mol氢气.
(1)计算溶液中氢氧根离子的物质的量浓度(忽略溶液体积变化).
(2)计算并确定该钠-钾合金的化学式.
3.氢氧化钠溶液处理铝土矿并过滤,得到含铝酸钠的溶液.向该溶液中通入二氧化碳,有下列反应:
2NaAl(OH)4+CO2→2Al(OH)3↓+Na2CO3+H2O
己知通入二氧化碳336 L(标准状况下),生成24 mol Al(OH)3和15 mol Na2CO3,若通入溶液的二氧化碳为112 L(标准状况下),计算生成的Al(OH)3和Na2CO3的物质的量之比.
4.常温下,称取不同氢氧化钠样品溶于水,加盐酸中和至pH=7,然后将溶液蒸干得氯化钠晶体,蒸干过程中产品无损失.
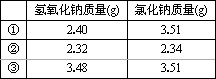
上述实验①②③所用氢氧化钠均不含杂质,且实验数据可靠.通过计算,分析和比较上表3组数据,给出结论.
钠是活泼的碱金属元素,钠及其化合物在生产和生活中有广泛的应用.完成下列计算∶
1.叠氮化钠(NaN3)受撞击分解产生钠和氮气,故可应用于汽车安全气囊.若78克叠氮化钠完全分解,产生标准状况下氮气________L.
2.钠-钾合金可在核反应堆中用作热交换液.5.05 g钠-钾合金溶于200 mL水生成0.075 mol氢气.计算溶液中氢氧化钠的物质的量浓度(忽略液体体积变化).
3.氢氧化钠溶液处理铝土矿并过滤,得到含铝酸钠的溶液.向该溶液中通入二氧化碳,有下列反应∶2NaAl(OH)4+CO2→2Al(OH)3↓+Na2CO3+H2O
己知通入二氧化碳112 L(标准状况下),生成的Al(OH)3和Na2CO3的物质的量之比为4∶5.若向该溶液中通入的二氧化碳为224 L(标准状况下),计算生成的Al(OH)3和Na2CO3的物质的量的最大值.
4.为测定某硫酸吸收含氨气废气后,所得铵盐中氮元素的质量分数,现将不同质量的铵盐固体分别加入到50.00 mL相同浓度的氢氧化钠溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解).该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量.部分测定结果如下表∶
试回答∶
该铵盐的成分为________.
该铵盐中氮元素的质量分数为∶________(须列式计算)
| A、钾与铯同一主族,铯比钾更难从水中置换出氢 | B、溴化钾与碘化钾溶液置于空气中,溴化钾更容易变质 | C、卤族元素气态氢化物的水溶液的酸性,从上到下依次增强 | D、卤族元素最高价氧化物对应水化物的酸性从下到上减弱 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com