
题目列表(包括答案和解析)
| O | - 3 |
铝士矿的主要成分中含有氧化铝、氧化铁和二氧化硅等,工业上经过下列工艺可以冶炼金属铝。下列说法不正确的是
A.①、②中除加试剂外。还需要进行过滤操作
B.a 、b中铝元素的化合价相同
C.③中需要通入过量的氨气
D.④进行的操作是加热,而且d 一定是氧化铝
铝士矿的主要成分中含有氧化铝、氧化铁和二氧化硅等,工业上经过下列工艺可以冶炼金属铝。下列说法不正确的是
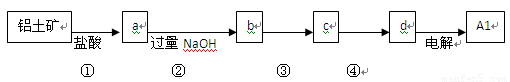
A.①、② 中除加试剂外。还需要进行过滤操作
B.a 、b中铝元素的化合价相同
C.③中需要通入过量的氨气
D.④进行的操作是加热,而且d 一定是氧化铝
(10分)已知高锰酸钾、二氧化锰在酸性条件下能将草酸钠(Na2C2O4)氧化:
MnO4—+C2O42—+H+―→Mn2++CO2↑+H2O(未配平);
MnO2+C2O42—+H+―→Mn2++CO2↑+H2O(未配平)。
为测定某软锰矿中二氧化锰的质量分数,准确称量1.20 g软锰矿样 品,加入2.68 g草酸钠固体,再加入足量的稀硫酸并加热(杂质不参加反应),充分反应后冷却,将所得溶液转移到容量瓶中用蒸馏水稀释至刻度,从中取出25.0 mL,用0.0200 mol·L-1高锰酸钾溶液进行滴定。当加入20.0 mL溶液时恰好完全反应,试根据以上信息完成下列各题:
品,加入2.68 g草酸钠固体,再加入足量的稀硫酸并加热(杂质不参加反应),充分反应后冷却,将所得溶液转移到容量瓶中用蒸馏水稀释至刻度,从中取出25.0 mL,用0.0200 mol·L-1高锰酸钾溶液进行滴定。当加入20.0 mL溶液时恰好完全反应,试根据以上信息完成下列各题:
(1)配平上述两个离子方程式:
___MnO+___C2O+___H+===___Mn2++___CO2↑+___H2O;
___MnO2+__C2O+___H+===___Mn 2++___CO2↑+__H2O。
2++___CO2↑+__H2O。
(2)欲求得软锰矿中二氧化锰的质量分数,还缺一个数据,这个数据是__________(填数据所代表的意义)。
(3)若该数据的数值为250,求该软锰矿中二氧化锰的质量分数(写出计算过程)。(4分)
铝士矿(主要成分为![]() 、
、![]() 、
、![]() )是提取氧化铝的原料.提取氧化铝的
)是提取氧化铝的原料.提取氧化铝的
工艺流程如下:
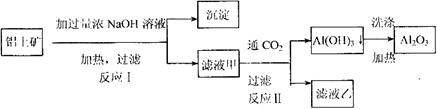
(1)写出反应Ⅱ的离子方程式_________________________________________________
(2)已知滤液乙的成分除![]() 外还含有
外还含有![]() 、
、![]() 中的一种或两种,所含物质的质量分数都在5%以上。请设计合理实验探究该滤液乙中
中的一种或两种,所含物质的质量分数都在5%以上。请设计合理实验探究该滤液乙中![]() 、
、![]() 的存在。仅限选择的仪器和试剂:烧杯、试管、带导管的橡皮塞、玻璃棒、蒸发皿、泥三角、三脚架、铁架台、酒精灯、过滤器、洗气瓶、滴管、药匙;lmol?L
的存在。仅限选择的仪器和试剂:烧杯、试管、带导管的橡皮塞、玻璃棒、蒸发皿、泥三角、三脚架、铁架台、酒精灯、过滤器、洗气瓶、滴管、药匙;lmol?L![]() 盐酸、2mol?L
盐酸、2mol?L![]() MgCl2溶液、澄清饱和石灰水。
MgCl2溶液、澄清饱和石灰水。
完成以下实验探究过程:
①提出假设:
假设1:滤液乙中除![]() 外还含有__________________;
外还含有__________________;
假设2:滤液乙中除![]() 外还含有_________________;
外还含有_________________;
假设3:滤液乙中除![]() 外还含有
外还含有![]() 、
、![]() ;
;
②设计实验方案:基于假设3,设计出实验方案(筒述实验操作、预期现象和结论)。
___________________________________________________________________________
__________________________________________________________________________。
(3)取滤液甲少许,加入过量盐酸,过滤;再用惰性电极电解其滤液,两极均有气体产生,且全部逸出,在阴极区还有沉淀生成,最后沉淀消失。沉淀消失的原因可用离子方程式表示为_____________________________________________________________
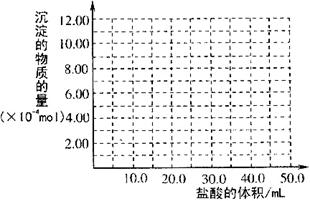 (4)取(3)电解以后的溶液10.0 mL,经分析,该溶液中只含有两种等物质的量浓度的碱性溶质,向其中逐滴加入0.100 mol?L
(4)取(3)电解以后的溶液10.0 mL,经分析,该溶液中只含有两种等物质的量浓度的碱性溶质,向其中逐滴加入0.100 mol?L![]() 盐酸溶液,当加入50.0mL盐酸溶液时,生成的沉淀恰好溶解。
盐酸溶液,当加入50.0mL盐酸溶液时,生成的沉淀恰好溶解。
①加入50.0mL盐酸溶液发生
的离子反应按先后顺序依次为
__________________________
__________________________。
②请画出生成沉淀的物质的量
与加入盐酸体积的关系图。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com