
题目列表(包括答案和解析)
(1)某化工厂排放的污水中含有Mg2+、Fe3+、Cu2+、Hg2+四种离子。甲、乙、丙三位学生分别设计了从该污水中回收纯净的金属铜的方案。
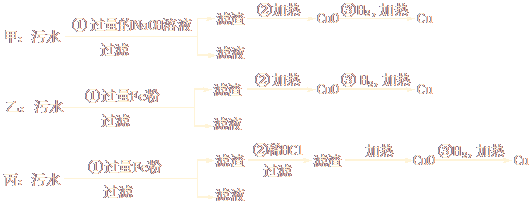
①甲、乙、丙提出的实验方案是否能得到纯净的金属铜?
甲________________,乙_____________,丙________________。(填“能”或“不能”)
②在能制得铜的方案中,哪一步操作会导致环境污染?_________________。应增加哪些措施防止污染?__________________________。
(2)已知MgCl2·6H2O晶体在空气中加热时,释放部分结晶水,同时生成Mg(OH)Cl(碱式氯化镁)或生成MgO。下列是关于MgCl2·6H2O的综合利用:

请回答下列问题:
①在图中的括号内填写适当的反应条件。
②Mg(OH)2固体存在如下溶解平衡:
Mg(OH)2(s)![]() Mg2++2OH-。向体系中加入(至少填两种不同类别的物质)______________,有利于Mg(OH)2溶解。
Mg2++2OH-。向体系中加入(至少填两种不同类别的物质)______________,有利于Mg(OH)2溶解。
③依据绿色化学的原子经济的概念(即化学反应的原料中每个原子都参与反应并全部转化为产物),203 kg MgCl2·6H2O原料,可以获得29.8 kg MgO、________kg 36.5%的盐酸和________kg MgCl2。
说到气体摩尔体积,不能忽视阿伏加德罗定律.为了测定某气体(丁烷,并含少量丙烷等气态烃)样品的平均相对分子质量,某学生设计了如下实验:
①取一个洁净、干燥并配有合适胶塞的锥形瓶,准确称量,得到质量m1;
②向锥形瓶中通入干燥的该气体样品,塞好胶塞,准确称量,重复操作,直到前后两次称量的结果基本相同,得到质量m2;
③向锥形瓶内加满水,塞好胶塞,称量得到质量m3.
[温度:T(K),压强:p(kPa),水的密度:ρ水(g/L),空气的平均式量:29.0,空气的密度ρ空气(g/L)]
请你依据该同学的操作回答下列问题:
(1)步骤②中重复操作的原因是________;
(2)简述在此实验中,如何做到每次测量都是在相同的体积下进行:________;
(3)锥形瓶内空气的质量(m空气)是________(列出算式,下同);
(4)瓶中样品气的质量(m样品)是________;
(5)由实验测得样品气的平均相对分子质量是________;
(6)通过本实验,你得出的结论是________(写一条即可).
|
(16分)粉煤灰,是从煤燃烧后的烟气中收捕下来的细灰,粉煤灰是燃煤电厂排出的主要固体废物。我国火电厂粉煤灰的主要氧化物为:SiO2、Al2O3,还含有FeO、Fe2O3等。现将提取粉煤灰中Al、Si等元素,某科研小组的同学设计了如下工艺流程:  请回答下列问题: (1)操作i所需要的玻璃仪器有: (填序号)。 a.铁架台 b.烧杯 c.冷凝管 d.玻璃棒 e.集气瓶 f.分液漏斗 g.漏斗 (2)写出粉煤灰与过量NaOH溶液反应的离子方程式 。 (3)写出向固体A中加入过量稀H2SO4和过量H2O2时发生的离子反应方程式 。 (4)写出生成固体H的离子方程式 。 (5)该科研小组的同学准备用0.1 mol·L-1KSCN溶液和0.5000mol·L-1KI溶液滴定溶液B,以测定粉煤灰中Fe元素的含量: ①为减小实验误差,由固体A制备溶液B过程中煮沸的目的是 (请用化学方程式表示)。 ②判断滴定终点的现象为 。 ③将溶液B配制成250mL溶液后,取出25.00mL装入锥形瓶中,再滴入1~2滴KSCN溶液进行滴定,滴定过程中使用KI溶液的量如下表所示:
④若滴定操作太慢,则滴定结果 (填“偏小”、“偏大”或“无影响”);原因是 (请用离子方程式及简单的文字描述)。 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com