
题目列表(包括答案和解析)
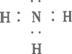
(1)在实验室用集气瓶收集气体G和气体H。则收集气体G的方法是(写一种):__________
__________;检验气体H已收集满的方法是:__________。
(2)在实验室进行操作①时,除了使用酒精灯、铁圈、铁架台及夹持仪器外,还缺少的仪器是:____________;在进行操作②时,应在HCl的气氛中加热脱水,其目的是:__________。
(3)A+H2O![]() B+H的基本反应类型为__________,H的电子式为__________。
B+H的基本反应类型为__________,H的电子式为__________。
(4)如下图所示支管中,左管中放入MnO4固体,右管中放入小块钠,再向两管均加入适量8 mol·L-1的盐酸,半分钟后,盖上橡胶塞并将此支管固定在铁架台上。用一照相机对准此支管,按快门,闪光灯闪亮。请回答:
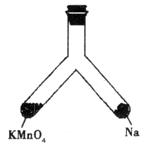
①“照相”之前,左管中反应生成的气体是__________(写化学式),若生成0.5 mol该气体,则转移电子的物质的量是__________mol。
②“照相”时,灯光闪亮,支管随之出现的现象是__________。
(16分)等电子原理的基本观点是:原子数相同且价电子总数相等的分子或离子具有相同的化学键类型和空间构型,互称为等电子体。等电子体的结构相似,物理性质相近。如:N2、CO与C22-、CN-为等电子体。
(1)已知CaC2为离子化合物,则CaC2的电子式为 。
(2)聚丙烯腈俗称人造羊毛,由丙烯腈分子CH2=CH—CN经聚合反应生成;则CH2=CH—CN中C原子的杂化方式为 ;分子中σ键和π键数之比为 。
(3)CO常与过渡金属原子M形成配合物M(CO)n ,其中满足中心原子价电子数与配位体提供电子总数之和为18,若M为Fe,则n= 。
(4)CO与N2的结构相似,分子中含有共价三键,可表示为C≡O ;下表是两者的键能数据(单位:kJ·mol-1)
| | C-O | C=O | C≡O |
| CO | 357.7 | 798.9 | 1071.9 |
| | N-N | N=N | N≡N |
| N2 | 154.8 | 418.4 | 941.7 |
研究化学反应实质,探究反应规律,是提高我们化学素养的有效手段,其中“以强制弱”的规律是我们所熟知的。
(1)今有HA、H2B两种弱酸,有如下关系:H2B(少量)+A-=== HB-+HA ,则在A-、HB-、B2-离子中,最易结合质子的是 ;
(2)酸性强弱除了与物质本身属性有关外,还和溶剂有关,如CH3COOH与HF在液氨中受NH3影响可发生完全电离。那么在液氨中反应:CH3COONa + HCl == NaCl + CH3COOH 能否发生,为什么? ;
(3)铝铵矾,其主要化学成分为十二水硫酸铝铵,向该盐的溶液中逐滴加入NaOH溶液,产生的现象有:
①溶液中出现白色沉淀;
②有刺激性气味的气体放出;
③白色沉淀量逐渐增多;
④白色沉淀逐渐消失;
请排出以上各种现象由先到后出现的正确顺序(用序号回答) ;
(4)在氧化还原反应中,也有“以强制弱”的类似规律。已知MnO2在酸性溶液中易被还原成Mn2+, MnO2、Cl2、FeCl3、I2的氧化性依次减弱。下列反应在水溶液中不可能发生的是( )
A.3Cl2 + 6FeI2 = 2FeCl3 +4FeI3 B.Cl2 + FeI2=FeCl2 +I2
C.MnO2+4HCl = MnCl2 +Cl2↑+2H2O D.2Fe3++2I-= 2Fe2++I2
| | C-O | C=O | C≡O |
| CO | 357.7 | 798.9 | 1071.9 |
| | N-N | N=N | N≡N |
| N2 | 154.8 | 418.4 | 941.7 |
Ⅰ、某同学根据离子方程式:2Fe3++Cu===2Fe2++Cu2+设计了一套原电池装置,从而实现了该反应。在下面画出该原电池的示意简图(正极材料为碳棒,标明正、负极及电极材料和电解质溶液)。
II 、锌锰干电池是应用最普遍的电池之一(如图所示),其基本反应为:
X极:Zn—2e-====Zn2+
Y极:2MnO2+2NH4++2e-====Mn2O3+2NH3+H2O
Y极是电池的_________(填“正”或“负”)极,若反应消耗16.25gZn,则电池中转移电子 的物质的是为________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com